突破性研究!空军军医大学雷杰/姜涛团队利用单细胞核RNA测序技术揭示两种罕见肺癌亚型的全新致病机制,锁定关键驱动基因
| 导读 | 这一发现为两种疾病的精准诊断和治疗提供了新方向。 |
近日,空军军医大学雷杰/姜涛团队在国际知名期刊《Clinical and Translational Medicine》发表一项突破性研究:通过对20例肺肉瘤样癌(PSC)、7例原发性肺肉瘤(PPS)和2例正常对照组织进行单细胞核RNA测序,揭示了这两种罕见肺部恶性肿瘤的细胞起源和分子特征差异。研究发现,PSC主要由上皮来源的AT2细胞通过上皮-间质转化(EMT)恶性演化而形成,而PPS则主要来源于成纤维细胞,这一发现为两种疾病的精准诊断和治疗提供了新方向。
研究背景:罕见肺部肿瘤的诊断困境
肺肉瘤样癌(PSC)和原发性肺肉瘤(PPS)是两类罕见的肺部恶性肿瘤,合计占所有肺部恶性肿瘤的不足1%。由于其罕见性和病理复杂性,这两种肿瘤的诊断和治疗一直是临床上的难题。PSC是一种同时含有上皮和肉瘤成分的双相肿瘤,属于非小细胞肺癌的特殊亚型。
单细胞技术揭示细胞起源之谜
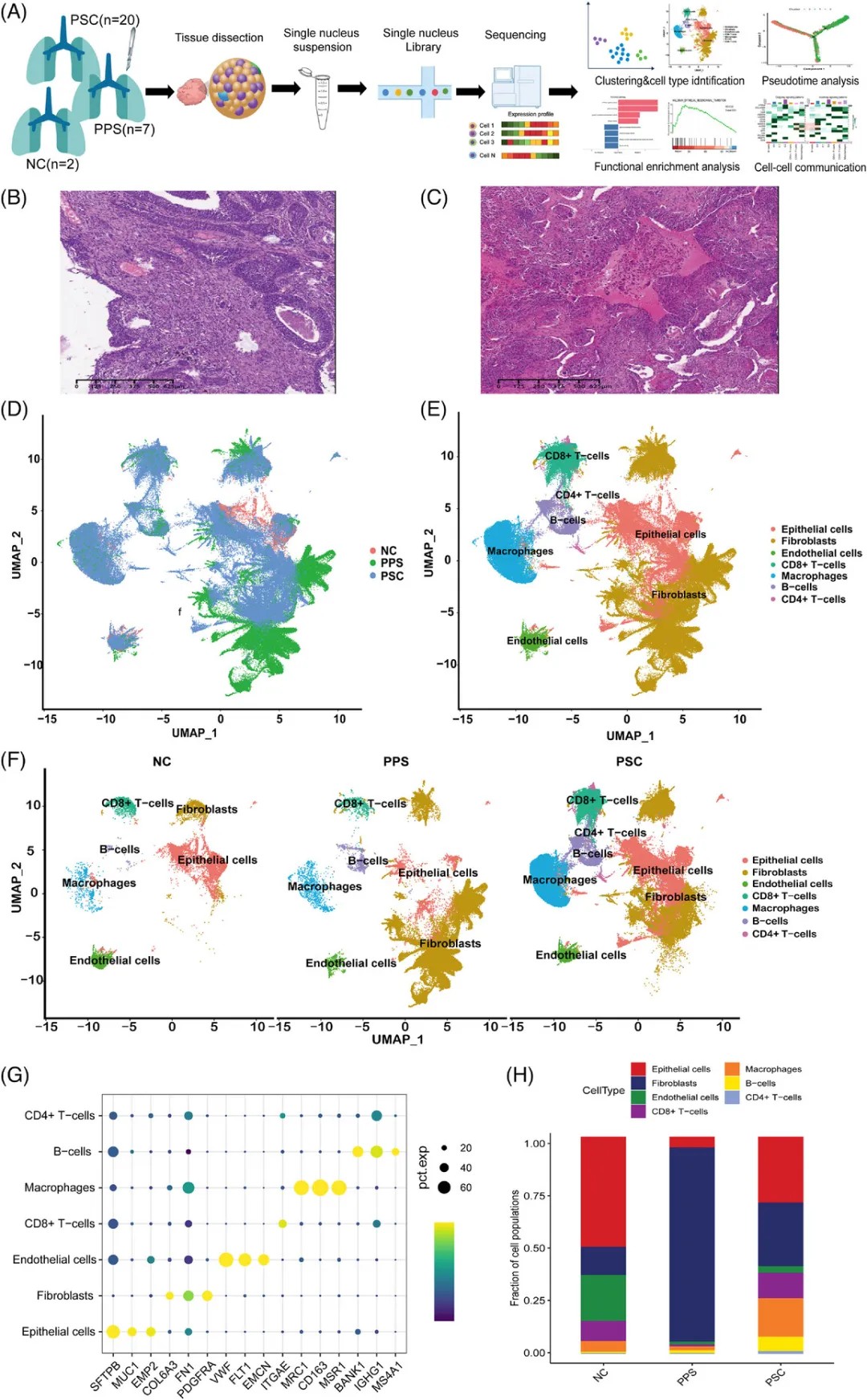
PPS 和 PSC 的细胞图谱
研究团队应用单细胞核RNA测序技术,对27例肿瘤样本和2例正常组织进行了分析,共获得181,764个高质量细胞的数据。
细胞图谱分析显示,PSC和PPS在细胞组成上存在显著差异。PSC中上皮细胞占比达30.4%,而PPS中上皮细胞仅占4.8%;相反,PSC中成纤维细胞比例为29.4%,而PPS中高达89.8%。
通过拷贝数变异分析,研究人员成功区分了恶性与非恶性细胞。在PSC中,绝大多数恶性细胞来源于AT2细胞,这些细胞表现出显著的上皮-间质转化特征。
值得一提的是,AT2细胞是肺腺癌的主要细胞起源,但本研究首次发现其在PSC的恶性转化中同样扮演关键角色。
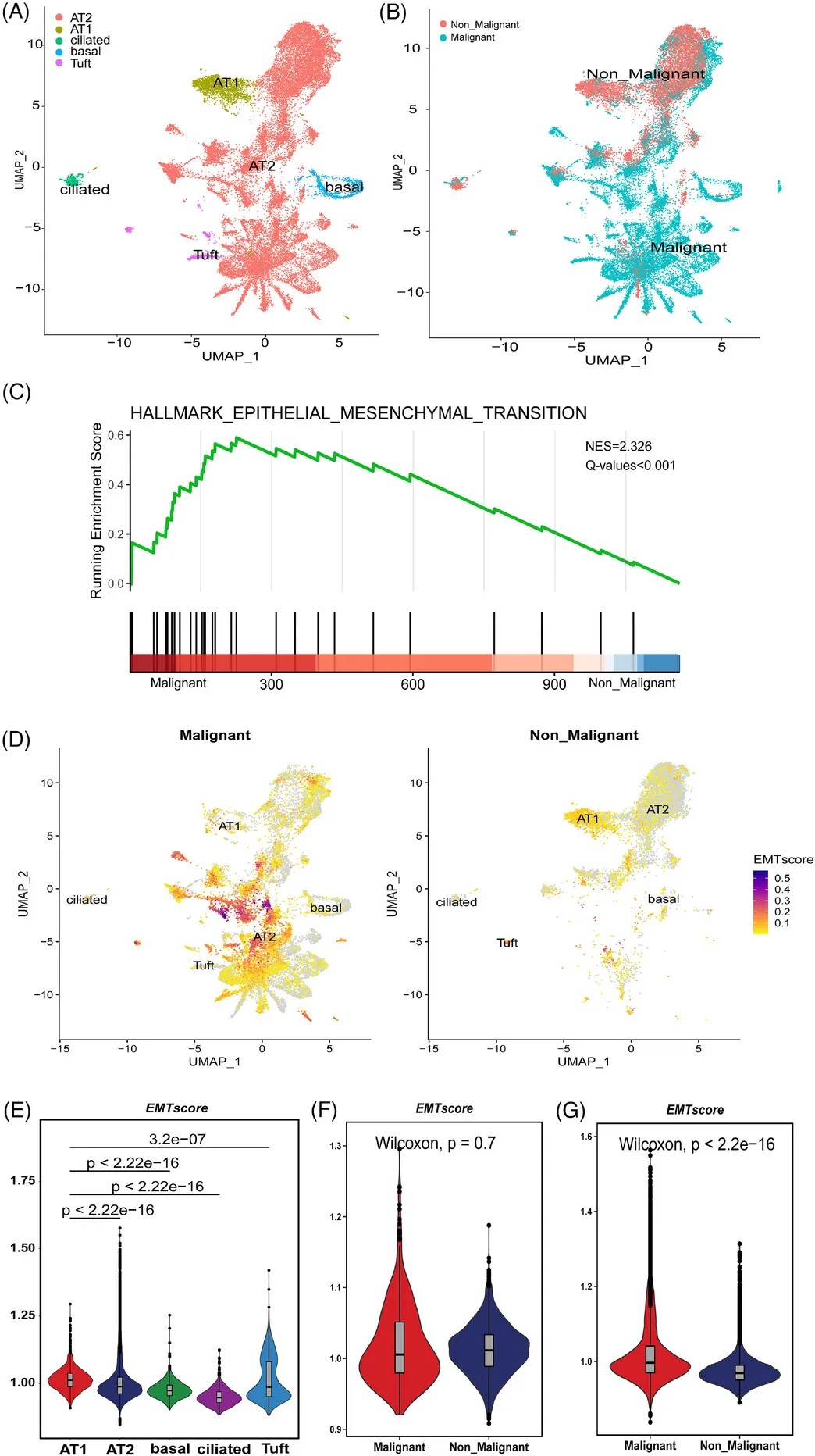
PSC 中上皮细胞的分类
PPS 中上皮细胞的分类及 PSC 和 PPS 中的富集通路
发现恶性进展的关键驱动因子

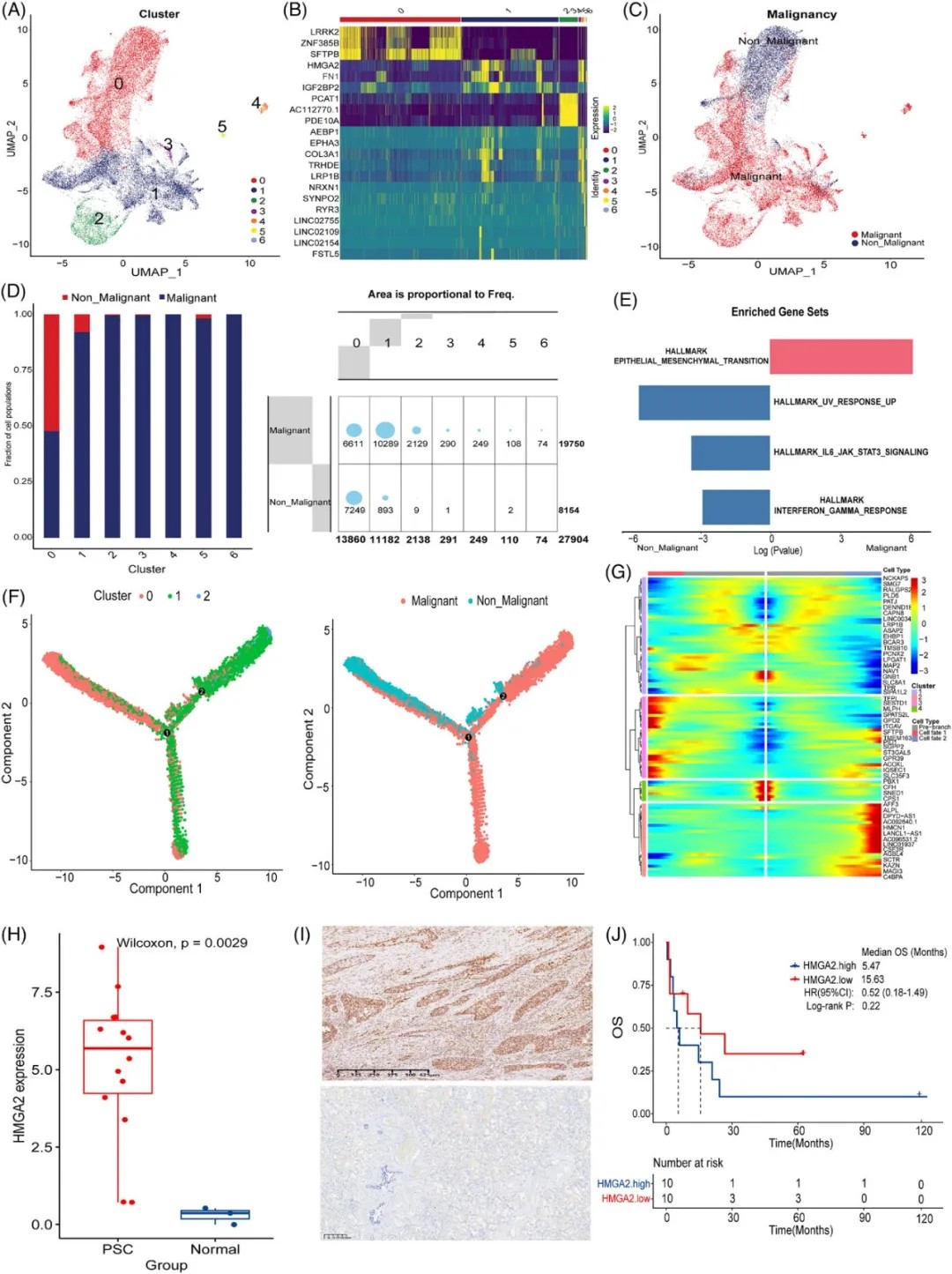
HMGA2+ 亚型细胞促进 PSC 的恶性进展
研究发现,HMGA2在PSC的恶性AT2细胞中表达显著上调。HMGA2作为上游介质调控多个关键信号通路,其高表达与患者预后不良相关。研究数据显示,HMGA2高表达患者的中位总生存期仅为5.47个月,而低表达患者为15.63个月。
进一步分析发现,MET基因突变与HMGA2表达密切相关。在PSC患者中,MET突变患者的HMGA2表达水平显著高于非突变患者。
MET基因是PSC的重要驱动基因,在PSC中的突变率高达8%-31%。这一发现为理解MET突变促进肿瘤恶性进展的机制提供了新视角。

HMGA2 与驱动基因的关系及转录因子分析
肿瘤微环境的细胞通讯网络
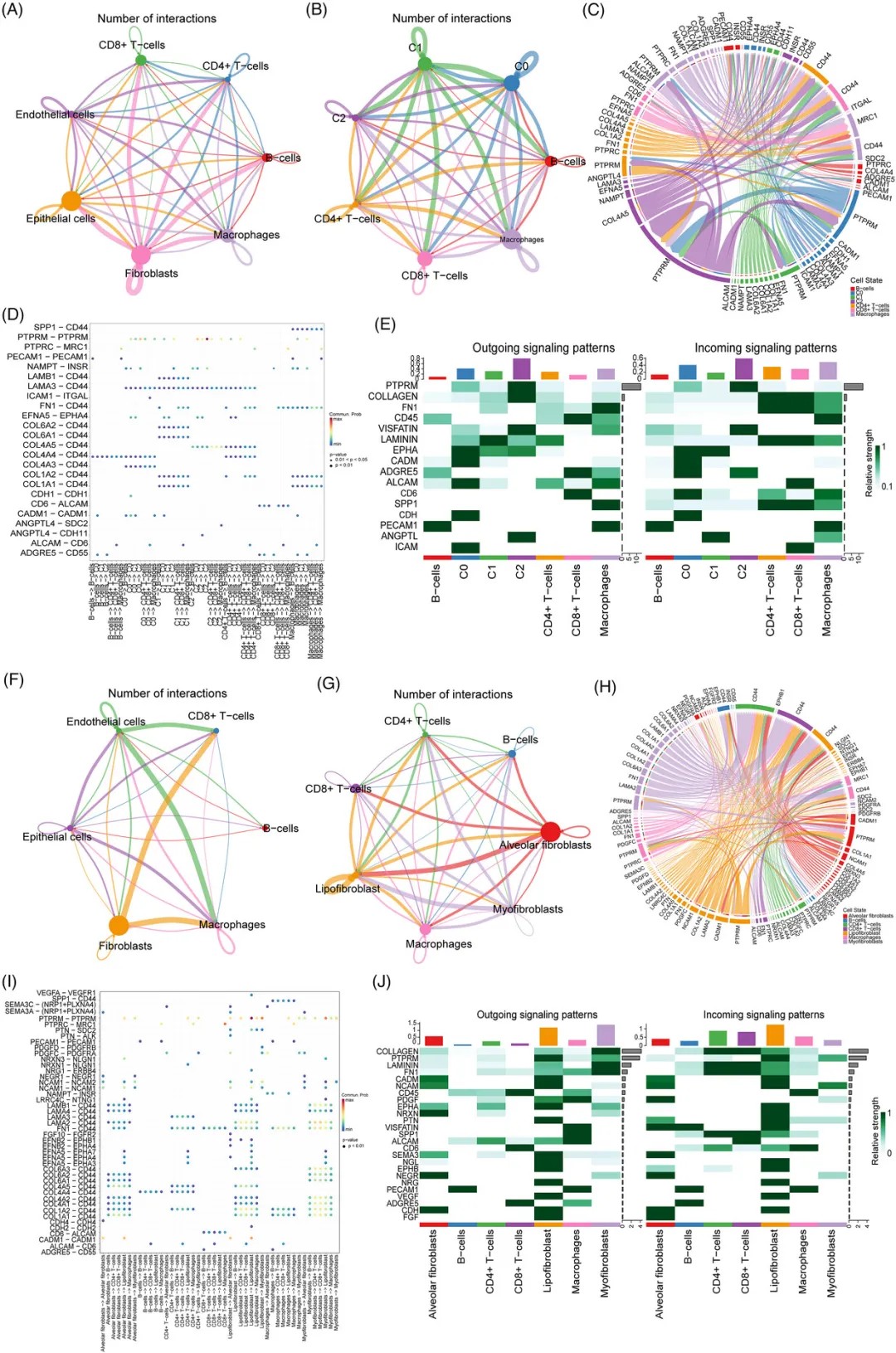
PSC 和 PPS 中的细胞间通讯分析
研究人员利用CellChat工具分析了肿瘤微环境中的细胞间通讯网络,发现AT2细胞亚群在细胞通讯中起枢纽作用。
在PSC中,AT2-C1细胞亚群与免疫细胞和内皮细胞之间存在广泛而强烈的相互作用。这些相互作用主要由PTPRM、胶原蛋白和纤维连接蛋白等配体与受体介导。
在PPS中,脂质成纤维细胞是细胞通讯的主要协调者,它们通过多种信号分子与免疫细胞相互作用。值得注意的是,CD44受体在两种肿瘤的微环境通讯中均扮演重要角色,成为最常见的共享受体。
研究意义与未来展望
本研究首次在单细胞分辨率下系统揭示了PSC和PPS的细胞起源和肿瘤微环境特征,为这两种罕见肺部恶性肿瘤的精准诊断和治疗提供了重要依据。
HMGA2可作为PSC预后评估的潜在生物标志物,尤其是对于MET突变患者。同时,针对HMGA2及其相关信号通路的治疗策略可能为PSC患者提供新的治疗选择。
对于PPS,脂质成纤维细胞特异的DNA修复通路富集提示,PARP抑制剂等靶向DNA修复的药物可能具有潜在治疗价值。随着对罕见肿瘤分子机制认识的深入,将为这些“孤儿肿瘤”患者带来新的希望。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/ctm2.70566(转化医学网360zhyx.com)
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发