STTT | 研究团队发现腹主动脉瘤形成的关键信号分子,首次系统性揭示其核心作用机制
| 导读 | 这一发现不仅深化了我们对疾病机理的理解,更指明了靶向MAPK14可能是治疗腹主动脉瘤的极具前景的新策略。 |
近日,研究团队在国际知名期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)发表了一项重磅研究:首次系统性地揭示了关键信号分子MAPK14(又称p38α)在腹主动脉瘤(AAA)形成中的核心作用机制。该研究通过整合单细胞多组学、表观遗传学及深入的分子生物学验证,发现MAPK14通过操控一个关键的转录调控网络,驱动血管平滑肌细胞(VSMC)退化,最终导致腹主动脉瘤的发生。这一发现不仅深化了我们对疾病机理的理解,更指明了靶向MAPK14可能是治疗腹主动脉瘤的极具前景的新策略。
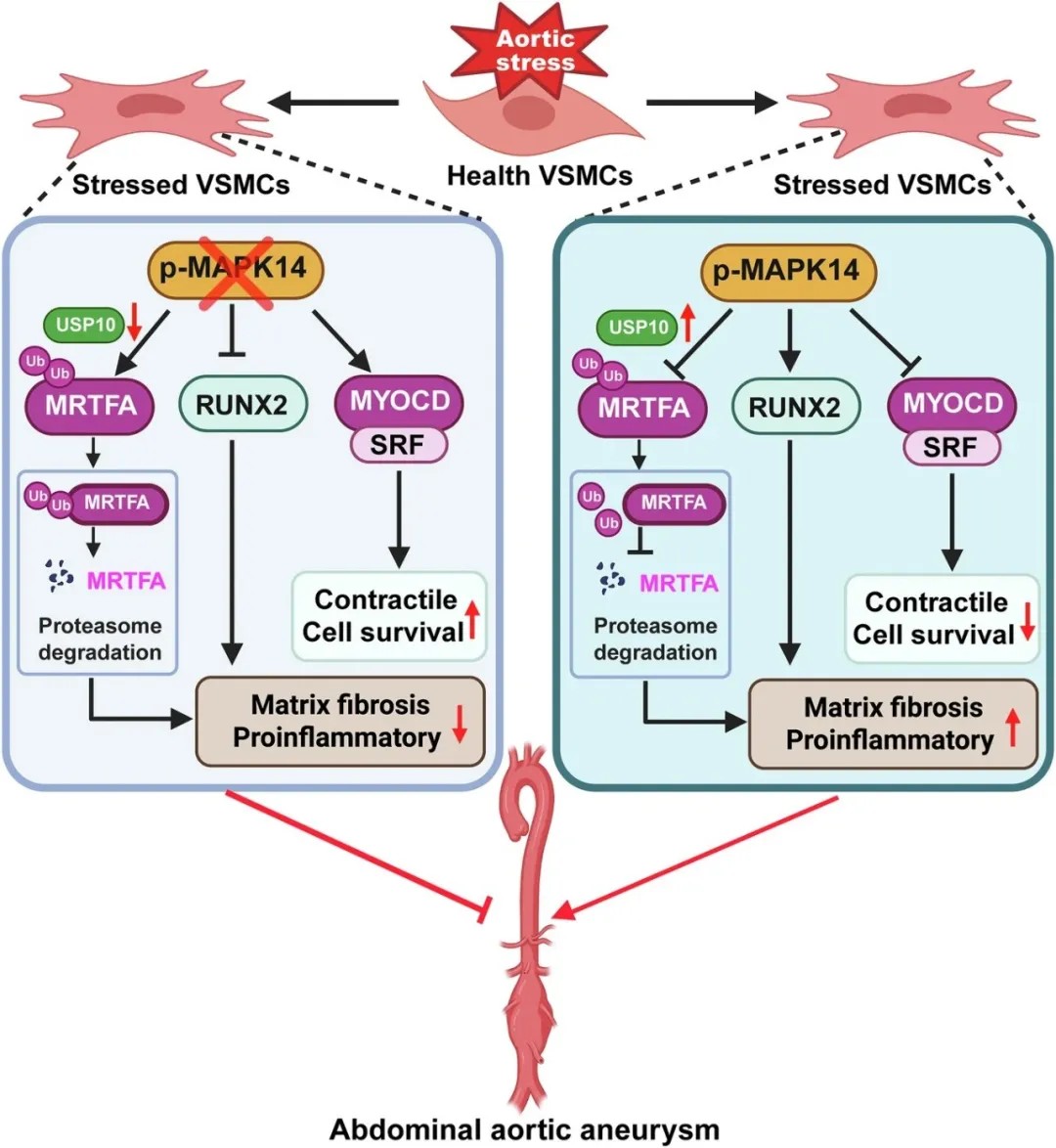
图形摘要
研究背景:致命的腹主动脉瘤与“叛变”的平滑肌细胞
腹主动脉瘤是一种致命的血管疾病,其特征是腹主动脉壁像气球一样异常膨出、变薄,一旦破裂死亡率极高。目前,尚无有效的药物治疗方法。血管平滑肌细胞是维持主动脉壁结构和功能的核心单元。在疾病过程中,原本具有收缩功能的健康平滑肌细胞会发生“退化”或“表型转换”,转变为促炎、促纤维化、易凋亡的异常状态,这是导致主动脉壁结构破坏、动脉瘤形成的关键环节。然而,驱动这一“叛变”过程的上游信号和核心转录机制一直不甚明了。
研究突破:多组学技术联手,绘制MAPK14的“犯罪地图”
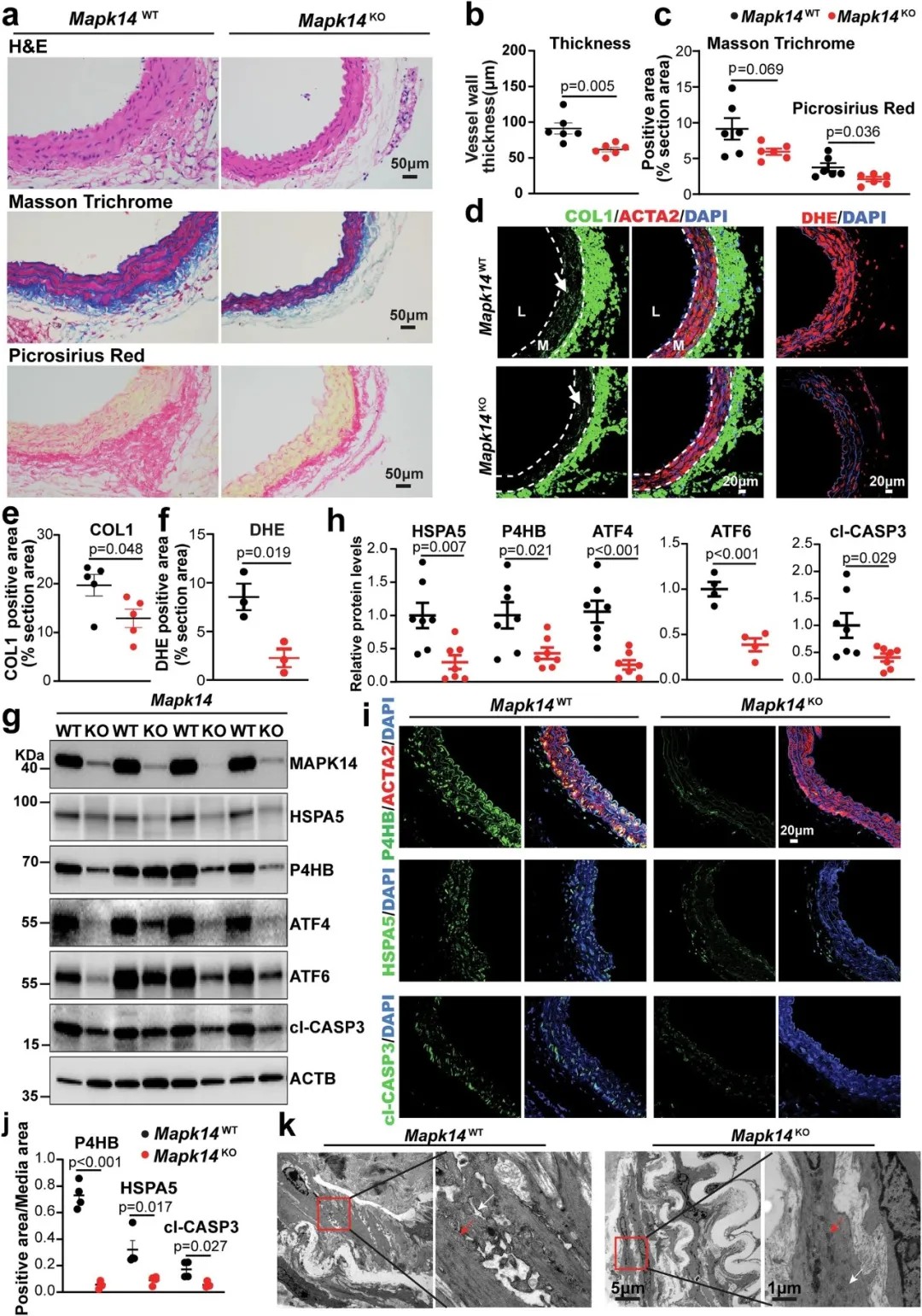
血管平滑肌细胞(VSMC)中MAPK14的缺乏阻碍了血管紧张素II(Ang II)诱导的主动脉重塑和VSMC退化
为了解开谜团,研究团队构建了血管平滑肌细胞特异性敲除MAPK14基因的小鼠模型,并利用血管紧张素II(Ang II)诱导其发生腹主动脉瘤。通过对比基因敲除小鼠与野生型小鼠,研究人员运用了前沿的单核RNA测序(snRNA-seq)和单核ATAC测序(snATAC-seq)技术,在单细胞分辨率下描绘了疾病过程中细胞群体和基因调控网络的动态变化。
研究结果揭示了令人震惊的差异:
-
细胞层面的保护: 与野生型小鼠相比,MAPK14敲除小鼠的主动脉中,健康的、具有收缩功能的平滑肌细胞比例显著增加,而促纤维化、促炎性的退化平滑肌细胞亚群以及免疫炎症细胞浸润则大幅减少。
-
功能逆转: 在分子水平上,敲除MAPK14显著减轻了内质网应激、氧化应激和细胞凋亡,同时增强了与肌肉收缩、钙离子信号传导等相关的健康基因程序。
核心机制:MAPK14是转录调控的“总开关”
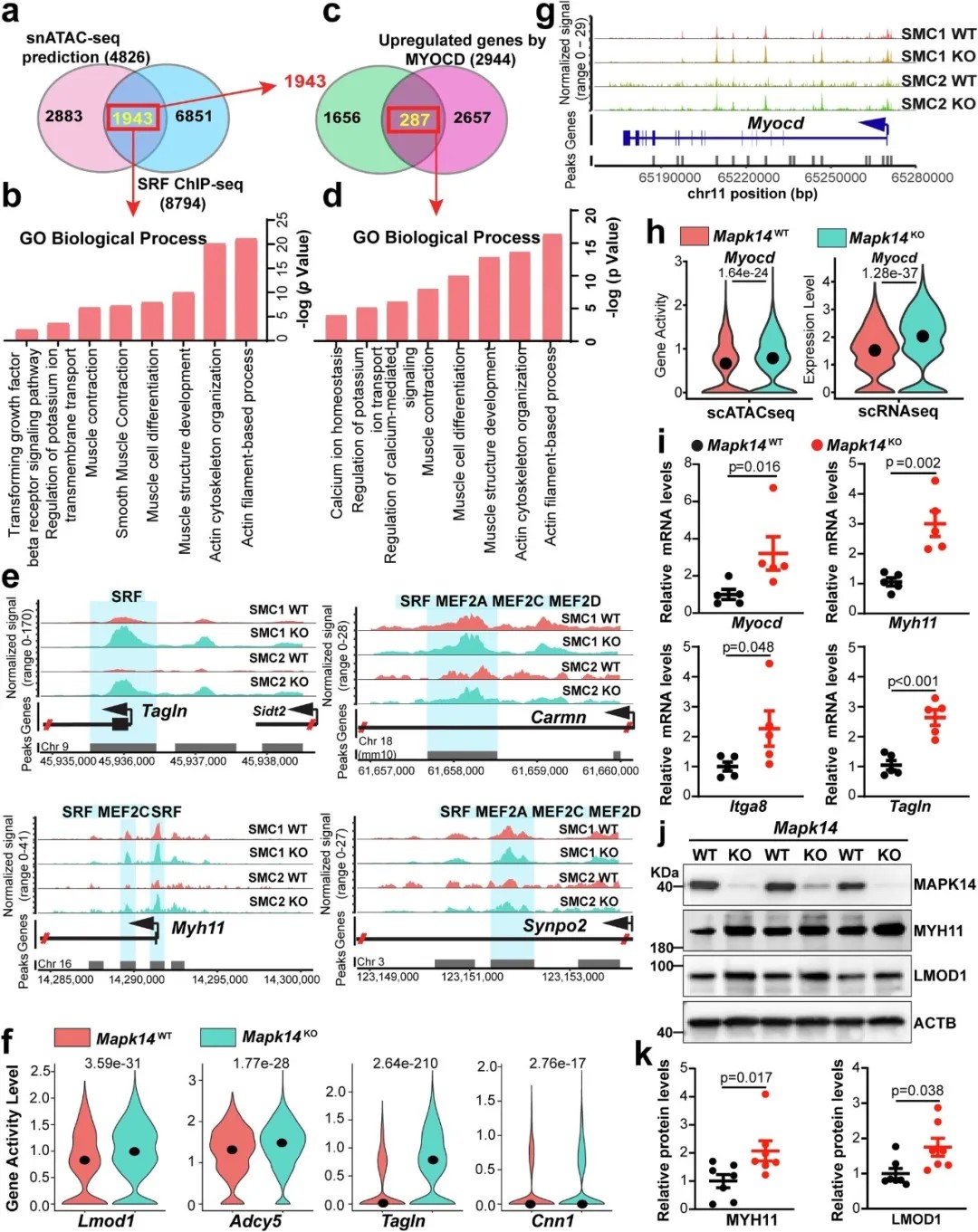
整合单核ATAC测序(snATAC-seq)、染色质免疫沉淀测序(ChIP-seq)和普通RNA测序(bulk RNA-seq)的结果,确定了由VSMC中MAPK14缺失引起的、依赖于MYOCD/SRF/CArG三联体的收缩基因程序的反式激活
深入的分析揭示了MAPK14发挥作用的精确分子机制,它像一个“总开关”,通过双向调控下游的转录因子来主宰平滑肌细胞的命运:
-
激活保护性通路: 研究发现,MAPK14的缺失会增强MYOCD/SRF/CArG转录三联体的活性。这是维持平滑肌细胞收缩功能的核心“主控开关”。其活性上调直接促进了包括Myh11、Tagln等在内的收缩基因的表达,使细胞保持健康状态。
-
抑制破坏性通路: 与此同时,MAPK14的缺失会显著降低MRTFA和RUNX2这两种促退化转录因子的活性。
研究首次揭示,MAPK14能与MRTFA蛋白发生物理相互作用,并通过维持去泛素化酶USP10的表达,来阻止MRTFA蛋白被泛素-蛋白酶体系统降解。这意味着MAPK14是MRTFA的“稳定器”,确保其能持续发挥促炎、促纤维化的破坏作用。RUNX2是已知的驱动血管钙化和炎症的关键因子,研究证实其活性也受到MAPK14的正向调控。
临床转化与未来展望
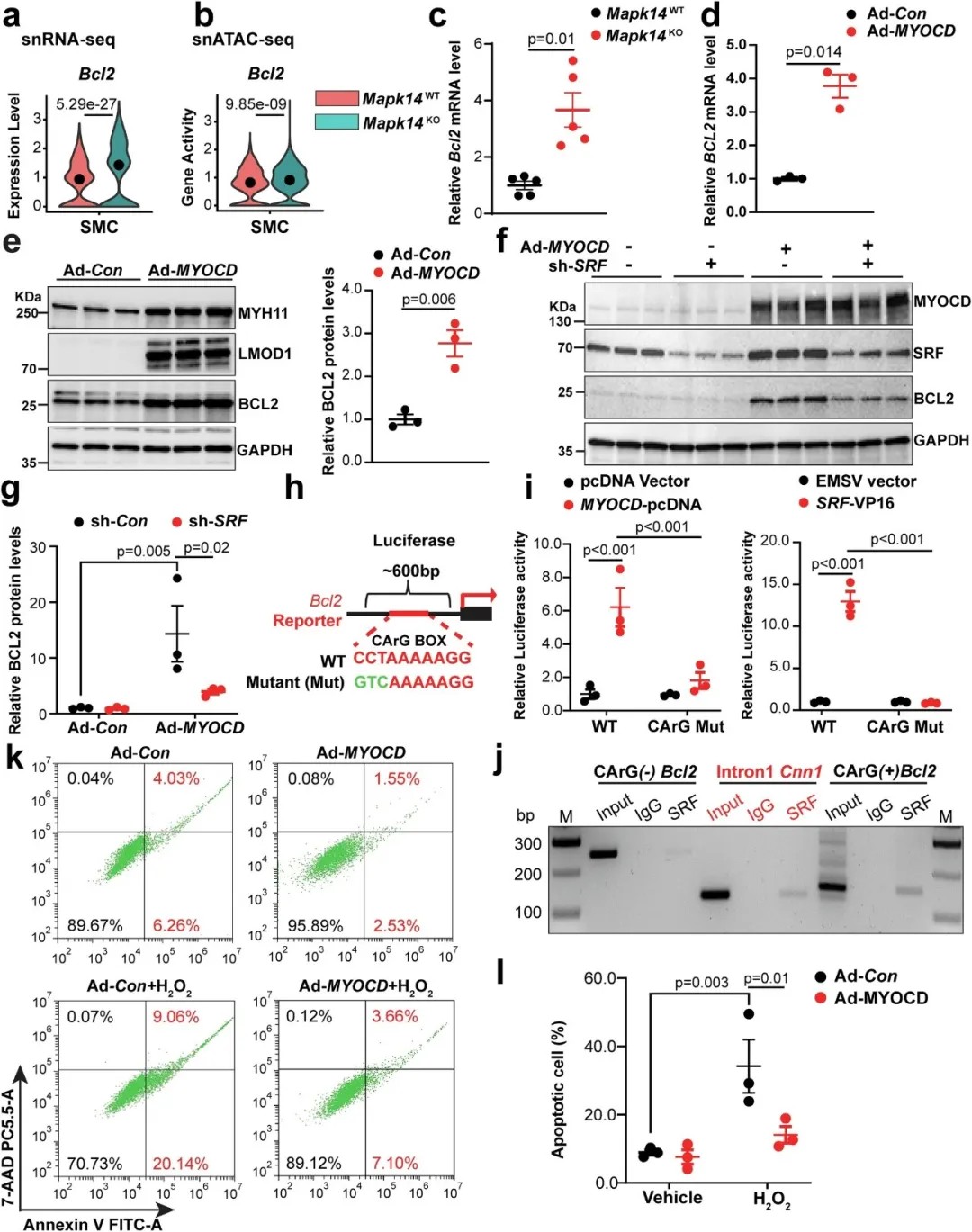
Bcl2是MYOCD/SRF/CArG三联体的一个新靶标,其表达因VSMC中MAPK14的缺失而上调
研究还鉴定出BCL2(一种重要的抗凋亡蛋白)是MYOCD/SRF/CArG通路的一个新靶标。在MAPK14敲除的细胞中,BCL2的表达上调,这为平滑肌细胞在应激环境下存活提供了另一层保护。在人类动脉瘤组织样本中,BCL2和MYOCD的表达水平确实低于正常组织,进一步验证了该通路在人类疾病中的相关性。
本研究首次清晰地描绘了MAPK14驱动腹主动脉瘤形成的完整通路:MAPK14通过抑制保护性的MYOCD/SRF通路、同时稳定破坏性的MRTFA蛋白并激活RUNX2,共同促使平滑肌细胞退化,最终导致动脉瘤。阐明了MAPK14作为一个核心枢纽,如何协调一系列复杂的转录和转录后事件来驱动血管疾病。这为开发针对腹主动脉瘤的精准疗法提供了坚实的理论基础。
原文链接:
https://www.nature.com/articles/s41392-025-02540-0(转化医学网360zhyx.com)
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发