振奋人心!南京医科大学孙明/卢凯华团队发现肺鳞癌治疗新靶点
| 导读 | 肺鳞状细胞癌(LUSC)是一种缺乏精确治疗的肺癌亚型。嵌合抗原受体T细胞(CAR-T)具有通过靶向特定抗原来消灭癌细胞的潜力。然而,以代谢异常为特征的肿瘤微环境(tumor microenvironment, TME)会抑制CAR-T的功能。 |
1月5日,南京医科大学孙明/卢凯华研究团队在期刊《Cell Death&Disease》上发表了研究论文,题为“Effects of methionine deficiency on B7H3-DAP12-CAR-T cells in the treatment of lung squamous cell carcinoma”。本研究中,研究人员发现B7H3在LUSC中高表达,并基于之前的发现开发了靶向B7H3的DAP12-CAR-T。研究人员确定B7H3是LUSC的潜在靶点,B7H3- dap12 - car - t细胞有望治疗LUSC。在CAR-T中维持Met水平可能有助于克服TME抑制,提高其临床应用潜力。

https://www.nature.com/articles/s41419-023-06376-w#Sec1
研究背景
01
肺癌是肿瘤死亡的主要原因,对公众健康构成严重威胁。非小细胞肺癌(NSCLC)是肺癌的主要组织学类型,包括肺腺癌(LUAD)和肺鳞状细胞癌(LUSC)。值得注意的是,靶向药物显著延长了驱动基因频繁突变的LUAD患者的生存期。同时,免疫治疗已成为肺癌治疗方案的重要组成部分。然而,由于LUSC驱动基因的低突变频率,LUSC的治疗仍然具有挑战性。由于免疫治疗标记物数量有限,只有约20%的LUSC患者可以从免疫检查点抑制剂(ICIs)中获益。LUSC的高肿瘤突变负荷(TMB)甚至可能反过来预测对ICI的不良反应。此外,抗血管生成药物如贝伐单抗会增加LUSC出血的风险。鉴于LUSC的一线治疗选择有限,研究人员研究了嵌合抗原受体T细胞(CAR-T)作为潜在替代疗法的治疗潜力。
研究亮点
02
Cancer Genome Atlas (TCGA)测序数据显示,B7H3转录本CD276在LUSC中高表达,而在正常组织中表达较低。相比之下,正常组织中的PDL1转录物CD274高于肺癌组织。研究人员比较了10例LUSC、LUAD、小细胞肺癌(SCLC)和正常组织中B7H3的表达。免疫组化结果显示B7H3在LUSC中高表达,在正常组织中表达较少。由48对LUSC和邻近肺组织组成的TMA进一步证实了这一点,表明LUSC中的B7H3高于邻近正常组织。根据DepMap数据库,CD276在28株LUSC细胞系中高表达,且高于CD274。根据DepMap的CRISPR筛选数据,敲除CD276抑制了22株LUSC细胞系,而CD274的缺失并未抑制它们的生长。qRT-PCR证实,B7H3在LUSC细胞株(SK-MES-1、H520和H1703)中的表达高于肺上皮细胞BEAS-2B (B2B)。IF染色结果显示B7H3在LUSC细胞株中大量表达。流式细胞术进一步证实了B7H3在H1703和H520细胞膜上的表达。因此,B7H3具有作为CAR-T治疗靶点的潜力。
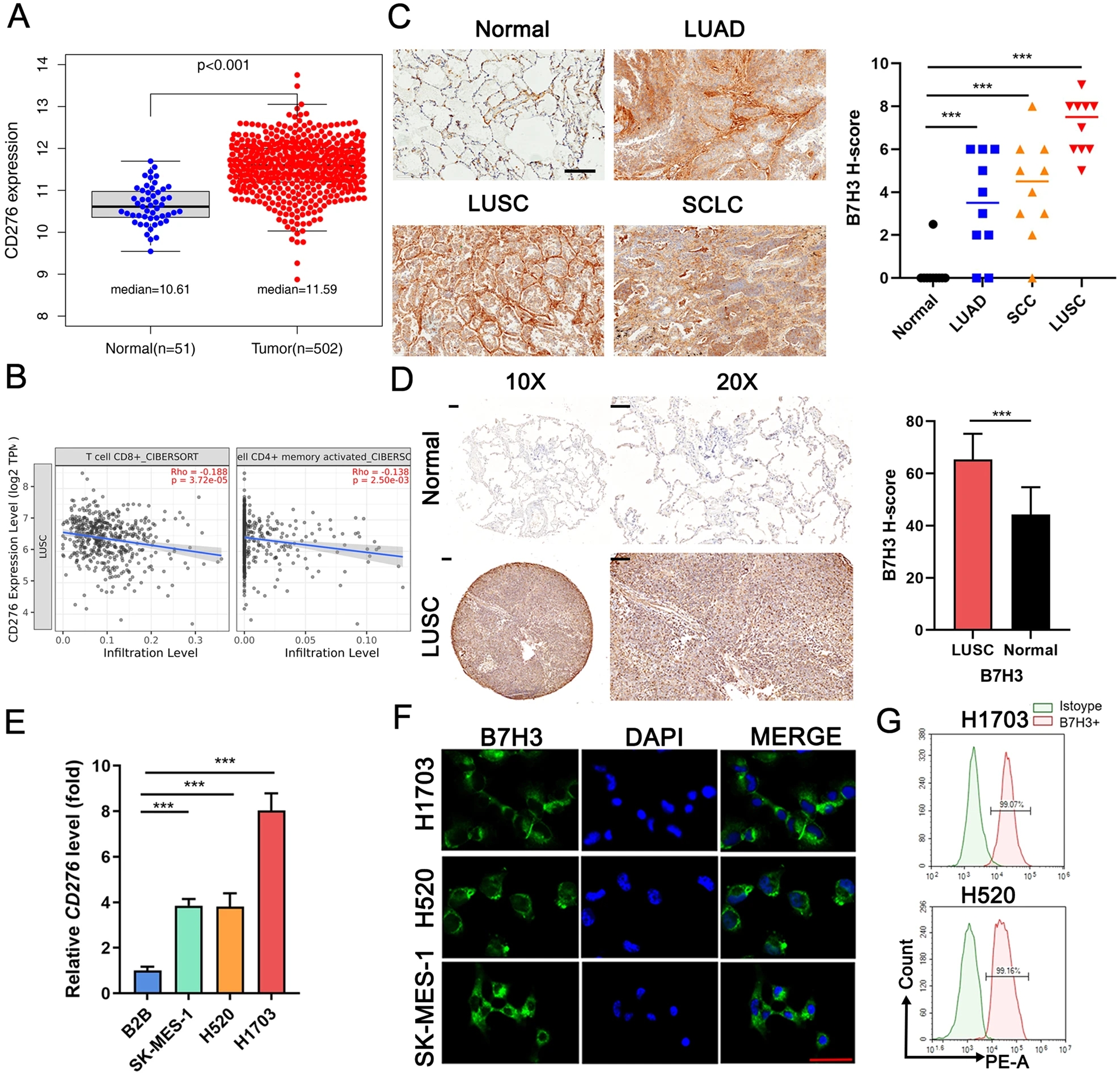
图1:B7H3在LUSC中高表达
根据T细胞标记物将T细胞分为4种表型,即幼稚型(Tn, CD45RO-CCR7 +)、中央记忆型(Tcm, CD45RO + CCR7 +)、效应型(Tem, CD45RO + CCR7-)和效应型(Teff, CD45RO-CCR7-) T细胞亚群。在第8天检测NTD和CAR-T的表型比率。与靶细胞共培养2 d后,CAR-T细胞中Tcm的比例高于NTD。此外,CAR-T和NTD的细胞凋亡率均< 10%。最后,研究人员评价了B7H3-DAP12-K-T细胞的体内抗肿瘤毒性,并与NTD相比,取得了较好的肿瘤生长控制效果。
TCGA结果显示,NKG7在肺鳞癌组织中低表达。Timer2.0显示,在肺鳞癌中,NKG7与CD8 + T细胞呈正相关,与肿瘤纯度呈负相关。根据已发表的单细胞测序结果,NKG7在T细胞中高表达。此外,根据单细胞转录组数据库TISCH2, NKG7在NSCLC样本的CD8 + T细胞和NK细胞中高表达。KEEG分析显示,与NKG7表达显著相关的基因富集在NK细胞药物作用的细胞毒性、细胞因子-细胞因子受体相互作用、TCR信号通路等。通过慢病毒转染上调CAR-T细胞中NKG7的表达,可以在低Met浓度下增强CAR-T细胞的杀伤活性,提示NKG7在CAR-T细胞的抗肿瘤功能中发挥重要作用。
研究结论
03
本研究表明,B7H3-DAP12-CAR-T能够有效清除LUSC细胞,然而,LUSC细胞通过SLC7A5战胜CAR-T细胞获得Met。Met缺乏导致NKG7下调,从而抑制细胞毒性。改善CAR-T的Met摄取有望增强杀伤功能,避免T细胞耗竭,从而改善个体化治疗结果。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-06376-w#Sec1
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发