接连两篇!同济大学研究成果登上Cell
| 导读 | 小细胞肺癌约占肺癌总数的15%,恶性程度高,难以通过基因突变信息获得有效靶点和分子分型,导致其治疗手段单一,患者总生存率一直止步不前。 |
2024年1月4日,同济大学医学院/附属上海市肺科医院张鹏教授团队、中国科学院上海药物研究所周虎研究员团队与中国科学院分子细胞科学卓越创新中心季红斌研究员团队、高大明研究员团队合作在国际顶级学术期刊《Cell》在线发表题为“Proteogenomic characterization of small cell lung cancer identifies biological insights and subtype-specific therapeutic strategies”的研究论文,首次在国际上大规模表征小细胞肺癌的蛋白组学图谱,为小细胞肺癌个性化治疗带来福音。

https://www.cell.com/cell/fulltext/S0092-8674(23)01335-1
研究概述
01
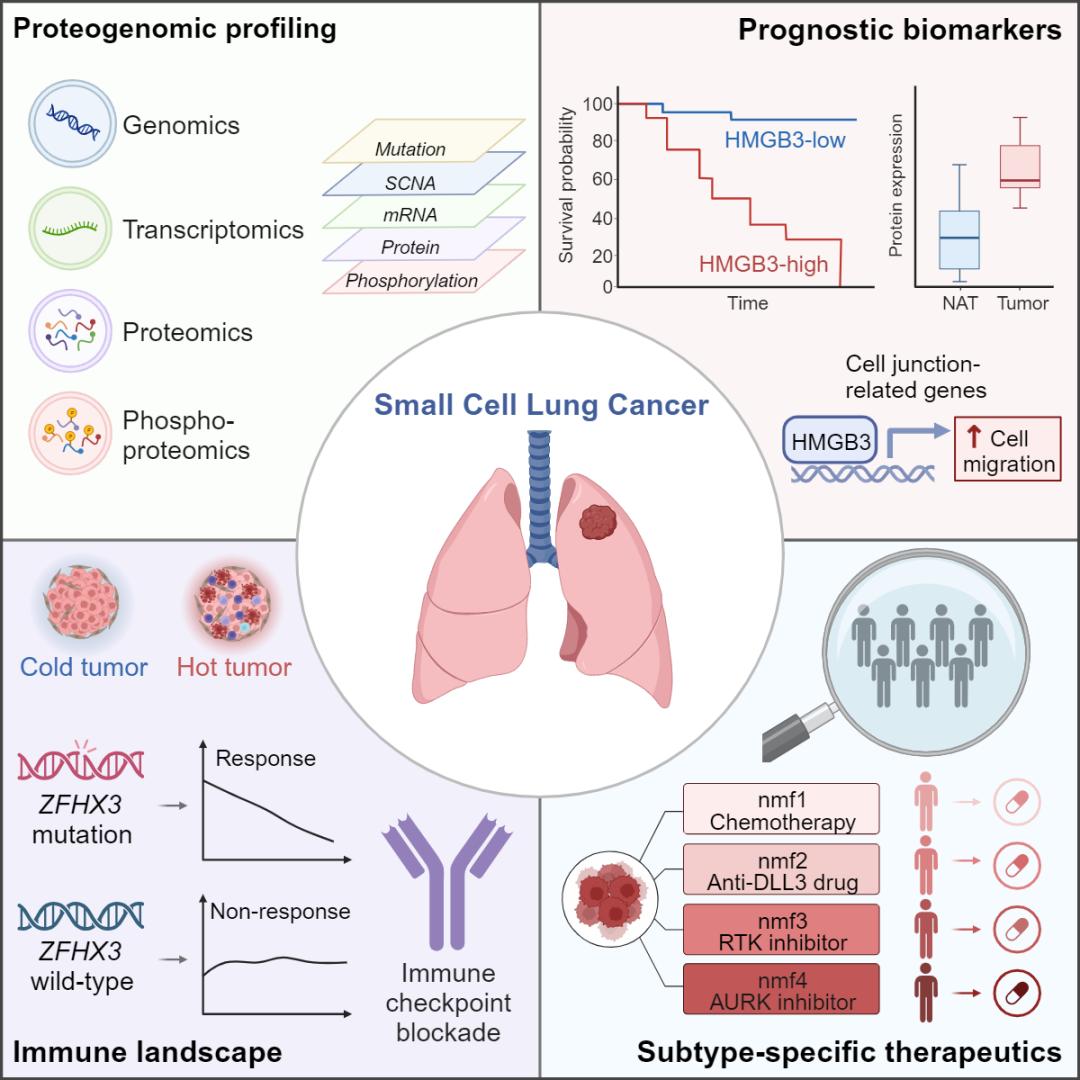
该研究对112例小细胞肺癌患者的肿瘤组织和配对癌旁组织样本进行了蛋白基因组学分析,通过整合基因组、转录组、蛋白质组、磷酸化蛋白质组等多维组学数据,系统揭示了小细胞肺癌的分子特征,为小细胞肺癌的发生发展机制、预后监测、分子分型和个性化治疗策略提供了新思路。
研究人员通过对蛋白质组学数据进行监督分析筛选预后相关生物标志物,发现HMGB3的高表达与患者不良预后密切相关,并通过免疫组化实验在独立队列临床样本中得以验证。从机制上讲,HMGB3可通过转录调控cell-junction相关基因表达促进小细胞肺癌的细胞迁移。然后,研究人员系统分析了小细胞肺癌的免疫微环境特征,发现ZFHX3突变与免疫细胞浸润水平升高密切相关。更重要的是,在接受PD-1或PD-L1抑制剂联合化疗的小细胞肺癌临床试验患者肿瘤样本中,证实了ZFHX3突变患者具有更好的治疗响应,提示ZFHX3突变或可作为小细胞肺癌免疫治疗受益的生物标志物。最后,研究人员利用多组学数据将小细胞肺癌分为四个亚型,系统表征了各亚型独特的分子特征并提出了潜在治疗策略。这些分子分型指导的特异性治疗策略通过患者样本来源肿瘤的小鼠移植瘤模型和人小细胞肺癌细胞系来源的小鼠移植瘤模型得以验证。
研究二
02
2023年12月20日,上海同济大学医学院/附属东方医院袁健教授课题组在《Cell》上发表了题为“Metabolic Regulation of Homologous Recombination Repair by MRE11 Lactylation”的研究成果,研究揭示了蛋白乳酸化修饰链接肿瘤代谢与DNA损伤修复的关键分子机制,并提供了潜在的肿瘤治疗靶点与策略。

https://www.sciencedirect.com/science/article/abs/pii/S009286742301276X
乳酸化是一种乳酸诱导的翻译后修饰,以其在表观遗传调控中的作用而闻名。本研究,研究团队发现,乳酸通过诱导DNA损伤修复关键蛋白——减数分裂重组蛋白11(MRE11)发生乳酸化修饰,促进同源重组修复(HR),导致化疗耐药的分子机制和生物学作用。
从机制上讲,MRE11(一种核酸酶,对起始DNA末端切割和同源重组修复具有重要的调控作用)能在乙酰转移酶CBP的催化下发生很强的乳酸化修饰。通过筛选和质谱分析,证实K673是MRE11发生乳酸化修饰的位点。此外研究还发现,高水平的MRE11 K673乳酸化修饰促进了MRE11与DNA的结合,从而促进了DNA末端切割和同源重组修复导致化疗耐药。使用特异性的小分子多肽靶向抑制MRE11 K673乳酸化修饰,能够显著增强铂类或PARP抑制剂化疗药物对肿瘤的杀伤效果。这些结果表明,抑制MRE11 K673乳酸化修饰是一种潜在的提高化疗效果的策略。
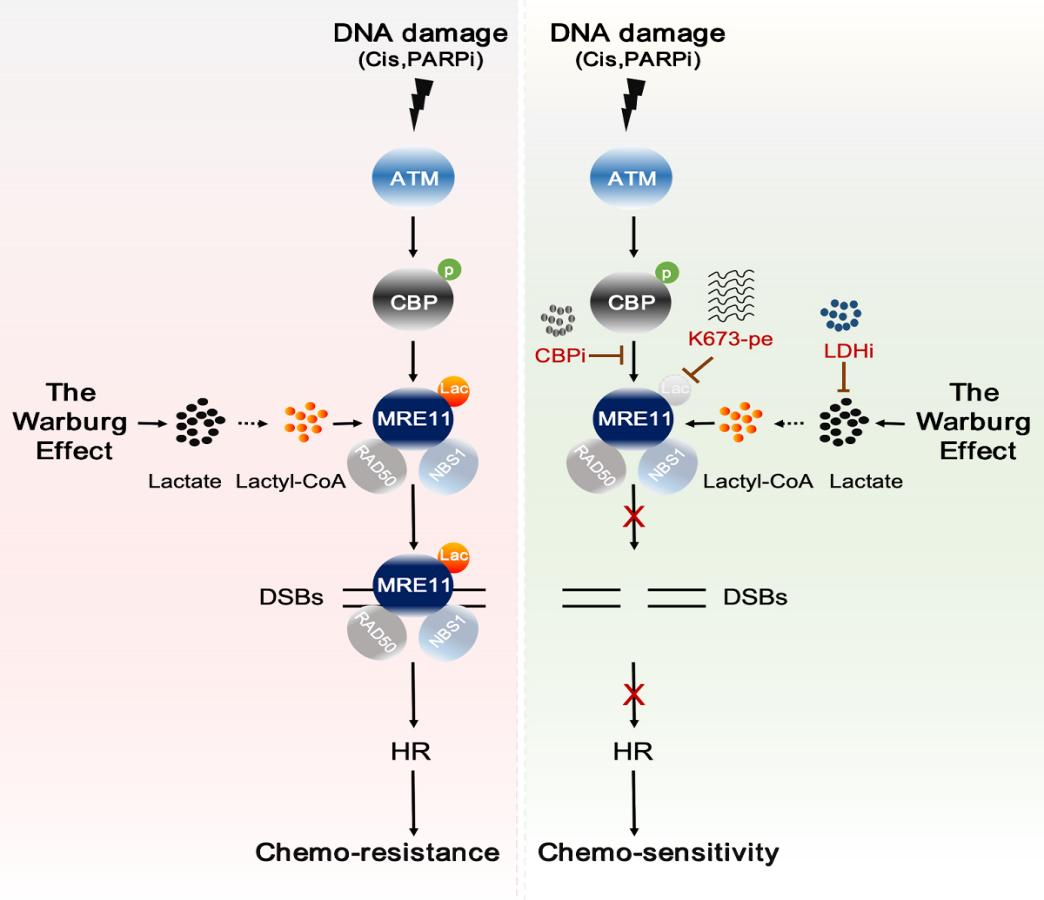
综上,这项研究揭示了细胞代谢与同源重组修复之间的关键分子链接及生物学基础并且为靶向DNA修复克服肿瘤耐药提供了新的理论基础和潜在靶点。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cell/fulltext/S0092-8674(23)01335-1
https://news.tongji.edu.cn/info/1003/86228.htm
https://med.tongji.edu.cn/info/1322/9505.htm
https://www.sciencedirect.com/science/article/abs/pii/S009286742301276X
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发