调节恶性肿瘤,刺激肿瘤进展!中山大学等研究人员最新发文
| 导读 | Aurora-A 激酶相互作用蛋白 1 (AURKAIP1) 已被证明通过作为 Aurora-A 激酶的负调节因子在癌症中发挥中介作用。然而,目前尚不清楚AURKAIP1本身是否会以及如何直接参与调节恶性肿瘤。 |
12月1日,中山大学研究人员联合湖南省常德市第一人民医院研究人员共同在期刊《Cell Death & Disease》上发表题为“AURKAIP1 actuates tumor progression through stabilizing DDX5 in triple negative breast cancer”的研究论文,我们的研究主要揭示了AURKAIP1/DDX5/β-catenin 轴调节 TNBC 进展的分子机制,表明AURKAIP1可能作为治疗靶点以及预后的 TNBC 特异性生物标志物。

https://www.nature.com/articles/s41419-023-06115-1
研究背景
01
毫无疑问,乳腺癌仍然是全球女性肿瘤负担的主要原因。大约10%-20%缺乏雌激素受体、孕激素受体(progesterone receptor, PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)的乳腺癌被归类为三阴性乳腺癌(triple negative breast cancer, TNBC),并且总是对TNBC患者构成治疗挑战。更不幸的是,TNBC表现出侵袭性的临床行为,这直接导致这部分乳腺癌患者的生存时间缩短。因此,仍然需要探索TNBC的潜在特异性靶点,作为未来治疗的基础。
AURKAIP1(Aurora-A激酶相互作用蛋白1)是一种Aurora-A激酶相互作用蛋白,涉及Aurora-A的两种降解途径,包括蛋白酶体依赖性途径和Ub非依赖性途径。AURKAIP1的异位表达导致Aurora-A蛋白水平下调,因此,AURKAIP1可被视为涉及Aurora-A通路的癌症抑制因子。有趣的是,在乳腺癌、胰腺癌和膀胱癌的几种类型的人类癌细胞中,也观察到Aurora激酶的AURKAIP1表达升高。除了这些相互矛盾的发现之外,一个更令人惊讶的发现是,过表达AURKAIP1的细胞仍然可以存活和增殖,即使AURKAIP1负调控的Aurora-A激酶在肿瘤发生中起着重要作用。阐明AURKAIP1在人类癌症中的确切作用和具体机制将充满意义。
研究进展
02
通过qRT-PCR和蛋白质印迹法,我们测定了不同细胞系中AURKAIP1的mRNA和蛋白水平,这表明与正常乳腺细胞系MCF 10A相比,TNBC细胞中的AURKAIP1表达显著更高(图2A)。为了确定AURKAIP1对TNBC的生物学效应,我们首先在MDA-MB-231和BT 549细胞系中敲低或过表达AURKAIP1(图2B)。CCK8增殖实验(图2D)和克隆形成实验(图2C)表明,基于siRNA的AURKAIP1敲低大大抑制了TNBC细胞的增殖能力,而过表达AURKAIP1则完全增强了TNBC细胞的增殖能力。重要的是,这些体外期望通过体内异种移植实验得到进一步证实(图2E)。然后,我们进行了transwell(图3A,B))和伤口愈合试验(图3C),以评估AURKAIP1是否影响了TNBC细胞迁移。结果表明,沉默AURKAIP1显著降低了细胞迁移能力,而过表达AURKAIP1则显示出相反的效果。综上所述,AURKAIP1失活损害了TNBC在体外和体内的细胞增殖和迁移。
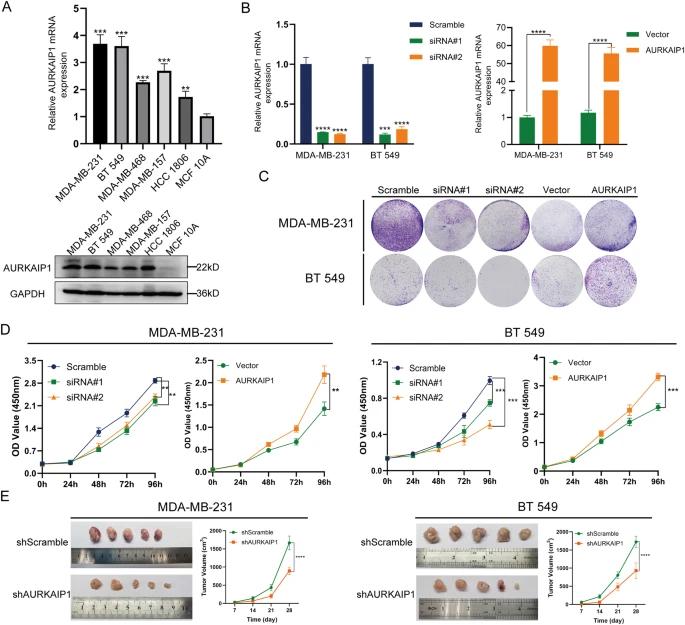
AURKAIP1促进了三阴性乳腺癌(TNBC)的细胞增殖和迁移。
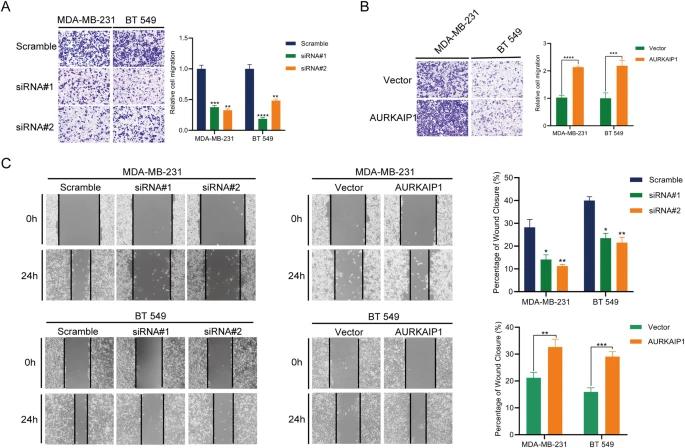
AURKAIP1对TNBC细胞迁移的贡献。
研究结论
03
总之,我们主要证明 AURKAIP1 上调并与 TNBC 的不良预后有关。AURKAIP1可直接与DDX5蛋白相互作用并稳定DDX5蛋白,提高其表达和β-连环蛋白活性。用siRNA治疗AURKAIP1可减缓肿瘤生长,这预示着AURKAIP1对TNBC的肿瘤发生和侵袭性至关重要。由于标本的局限性,AURKAIP1与DDX5或β-连环蛋白扩增水平的关联需要进一步研究,更多的TNBC病例需要进一步研究。既然AURKAIP1可以在TNBC中发挥不可忽视的作用,那么它的额外蛋白质伴侣和人类癌症的潜在机制值得深入研究。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-06115-1
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。

-
 游客2023-12-04 11:33:22可以申请公众号开白,转载文章贵公众号的文章吗?
游客2023-12-04 11:33:22可以申请公众号开白,转载文章贵公众号的文章吗?
 正在加载
正在加载 腾讯登录
腾讯登录








