全新发现!中国科学院/中山大学:实体瘤重要治疗靶点,尤其适用于结直肠癌
| 导读 | 10 - 11易位甲基胞嘧啶双加氧酶2 (TET2)突变引起的功能障碍在血液系统恶性肿瘤中被广泛报道。然而,TET2在包括结直肠癌(CRC)在内的实体癌中的作用尚不清楚。 |
10 - 11易位甲基胞嘧啶双加氧酶2 (TET2)突变引起的功能障碍在血液系统恶性肿瘤中被广泛报道。然而,TET2在包括结直肠癌(CRC)在内的实体癌中的作用尚不清楚。
近日,中国科学院广州生物医学与健康研究所的李长朋、郑辉研究团队与中山大学肿瘤防治中心的买世娟研究团队在《Cell Death&Disease》上发表题为“Nuclear localization of TET2 requires β-catenin activation and correlates with favourable prognosis in colorectal cancer”的文章。在本研究中,研究人员发现结直肠癌中TET2功能障碍主要是由于TET2核定位减少,并且TET2核定位与患者更好的生存相关。使用β-catenin通路激活剂IM12和TET2激活剂维生素C增强TET2在低表达条件下的作用,在体外和体内均观察到对肿瘤生长的协同抑制作用。总之,这些数据表明,β-catenin介导的TET2核定位是实体瘤的一个重要治疗靶点。

https://www.nature.com/articles/s41419-023-06038-x
研究背景
01
在包括癌症在内的造血系统疾病患者中,10 - 11易位甲基胞嘧啶双加氧酶2 (TET2)突变是最常见的遗传异常之一。TET2属于TET蛋白家族,催化5-甲基胞嘧啶(5-methylcytosine, 5mC)转化为5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)。多项研究表明,突变诱导的TET2功能障碍导致造血细胞系失调和随后发生的髓系异常。骨髓增生异常综合征、急性髓系白血病和淋巴系统恶性肿瘤的TET2突变频率分别约为20 ~ 35%、12 ~ 34%和2 ~ 33%。TET2突变与JAK2、ASXL1、SRSF2和KRAS突变协同驱动多种血液系统恶性肿瘤的发生发展。在实体瘤方面,有几篇论文报道了TET2在癌组织中的表达降低,以及在结直肠癌组织中TET2的核丢失。然而,TET2在实体癌中作用的潜在机制以及TET2的细胞定位的确切调控在很大程度上是未知的。
β-Catenin由CTNNB1基因编码,β-Catenin信号通路的异常与实体瘤的发生、发展、复发和化疗耐药有关,尤其是结直肠癌(CRC)。失活的β-catenin是维持细胞间黏附的重要黏附连接蛋白。一旦被激活,细胞黏附复合物被释放,上皮细胞转化为更多的间充质表型。在细胞质中,β-catenin与T细胞因子/淋巴增强因子家族1 (T-cell factor/lymphoid enhancer factor family 1, TCF/LEF-1)形成复合体后转位至细胞核,诱导WNT-β-catenin通路激活。所有这些发现都强烈支持活化的β-catenin是EMT和WNT/β-catenin通路的核心蛋白,并且与肿瘤状态的维持密切相关。
研究方法
02
TET2在结直肠癌的发生发展过程中发挥重要作用
为了确定TET2功能障碍的总体情况,研究人员在TCGA数据库中来自不同器官的癌症中检测了TET2的突变和表达。如前所述,在淋巴系和髓系肿瘤中发现了高频率的基因突变,其中约67%的突变位于催化结构域,影响TET2的DNA去甲基化活性。实体瘤的基因突变频率(1.93%,42224例实体瘤中有815例发生突变)和影响TET2活性的突变比例(18.7%,815例实体瘤中有152例突变位于催化结构域)均较低。相反,我们在包括CRC在内的数种实体瘤中发现了低水平的TET2 mRNA。因此,TET2功能障碍在实体瘤中的机制可能不同于血液肿瘤。
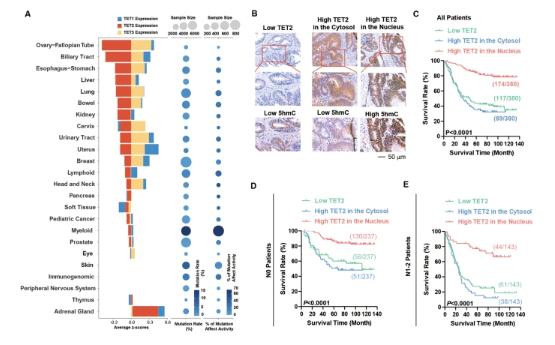
TET2在实体瘤中的功能障碍机制不同于血液肿瘤
研究意义
03
在本研究中,研究人员发现实体瘤和血液肿瘤之间TET2功能障碍的差异主要是由于细胞环境的差异。在实体瘤中,细胞通常通过黏附复合物相互粘附。E -钙黏蛋白(E-cadherin)和β-连环蛋白(β-catenin)是细胞黏附复合物的成员。然而,B细胞和T细胞表达与细胞间和细胞-底物相互作用相关的基因,如E -钙黏蛋白和N -钙黏蛋白,的表达水平相对较低。造血肿瘤细胞多在悬浮状态生长,不能利用E-cadherin将β-catenin锁定在膜复合物中。然而,在实体瘤中,当细胞感受到缺氧等EMT刺激时,E-cadherin被降解,不仅诱导间充质表型,而且从膜复合物中释放β-catenin。因此,β-catenin从细胞黏附复合物的释放是参与实体瘤发生发展的基本细胞过程。但是,血液癌细胞中没有这种现象。
本研究揭示了TET2在实体瘤中活性调节的独特机制。所有这些结果表明,TET2,特别是其定位和活性,是危及生命的晚期肿瘤的一个新的治疗干预靶点。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-06038-x
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发