最新!浙江大学联合温州医科大学等研究发现促进肿瘤免疫逃逸新机制
| 导读 | 肿瘤细胞经常过度表达免疫检查点蛋白,包括CD47,以进行免疫逃避。然而,受体酪氨酸激酶的致癌激活(肿瘤发展的关键驱动因素)是否或如何调节CD47表达尚不清楚。 |
近日,浙江大学吕志民教授和温州医科大学吕建新教授等共同在《Advanced Science》上发表题为“EGFR-Induced and c-Src-Mediated CD47 Phosphorylation Inhibits TRIM21-Dependent Polyubiquitylation and Degradation of CD47 to Promote Tumor Immune Evasion”的研究论文,研究阐明了EGFR激活的肿瘤细胞中CD47上调的新机制,并强调了EGFR-c-Src-TRIM21-CD47信号轴在肿瘤逃逸中的作用,以及通过CD47阻断与EGFR靶向疗法的组合来改善当前癌症治疗的潜力。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202206380
研究背景
先天免疫系统是抵御感染和恶性细胞转化的第一道防线。通过吞噬作用,抗原呈递细胞(APC),包括单核细胞、树突状细胞和巨噬细胞,是先天免疫系统的关键部分,能够捕获和消除转化的恶性细胞。此外,APCs作为适应性免疫系统的桥梁,并将肿瘤来源的抗原呈现给启动T细胞并激活下游适应性免疫应答。然而,肿瘤细胞经常过度表达免疫检查点蛋白以进行免疫逃避。整合素相关蛋白(IAP或CD47)是一种糖基化的五跨膜蛋白,经常在血液学和实体瘤中过度表达,使肿瘤细胞逃避先天免疫监视。CD47结合并激活信号调节蛋白α(SIRPα),SIRPα是一种在骨髓细胞表面表达的抑制蛋白,包括所有类型的巨噬细胞。SIRPα的激活启动抑制巨噬细胞吞噬活性的信号级联反应,因此CD47起到抗吞噬或“不要吃我”信号的作用,以避免吞噬细胞的自我消除。CD47阻断单克隆抗体用于癌症治疗已在多项临床试验中进行了研究。
CD47表达可以通过多种转录因子在转录水平上调节,包括信号转导器和转录激活因子3(STAT3),β-连环蛋白转录因子4(TCF4),缺氧诱导因子1(HIF-1),和c-Myc。然而,CD47表达是否在翻译后水平上受到调节,特别是在对肿瘤经常发生的受体酪氨酸激酶(RTKs)病变的反应中,从而有助于肿瘤免疫逃逸仍不清楚。此外,干预致癌信号传导调节的CD47表达是否可以使RTK靶向治疗致敏尚不清楚。
研究进展
在这项研究中,我们证明了CD47表达水平与人胶质瘤的分级和GBM患者的不良预后相关。从机制上讲,EGFR的扩增或突变是GBM中的主要受体酪氨酸激酶病变,发生在57%的肿瘤中,诱导CD47表达独立于其转录和翻译调控。EGFR活化增加了c-Src与CD47的结合,EGFR激活的c-Src在Y47处磷酸化CD288。这种磷酸化抑制了TRIM21和CD47之间的相互作用,从而消除了TRIM21介导的CD47 K99/102多泛素化和CD47降解。CD47 Y288F的敲入表达降低了CD47的表达,增加了巨噬细胞对肿瘤细胞的吞噬作用,并减少了肿瘤生长。相反,CD47 K99/102R的表达增加了CD47的表达,相应降低了肿瘤细胞的巨噬细胞吞噬作用,促进了肿瘤生长。重要的是,与单独使用任何一种治疗相比,抗CD47抗体治疗的CD47-SIRPα阻断显著增强了EGFR靶向癌症治疗,并引发了更大的肿瘤生长抑制。
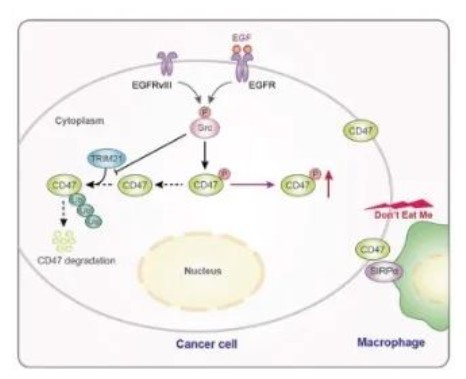
c-src调控的CD47磷酸化和表达示意图。
研究意义
总之,在这项研究中,我们证明了表皮生长因子(EGF)受体(EGFR)的激活导致c-Src介导的CD47 Y288磷酸化,随后消除泛素E3连接酶三方基序蛋白21(TRIM21)与CD47的结合,从而消除TRIM21介导的CD47 K99/102多泛素化和CD47降解。CD47 Y288F敲入表达降低CD47表达,增加肿瘤细胞巨噬细胞吞噬作用,抑制小鼠脑肿瘤生长。更重要的是,CD47阻断增强了EGFR靶向癌症治疗。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202206380
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发