抗癌细胞!中国科学院大学/川大华西医院共发乳腺癌治疗关键靶点
| 导读 | 乳腺癌可以转移到各种器官,包括肺。待转移器官的免疫微环境在乳腺癌的转移中起着至关重要的作用。病毒和细菌等病原体感染会改变肺部的免疫状态。 |
乳腺癌可以转移到各种器官,包括肺。待转移器官的免疫微环境在乳腺癌的转移中起着至关重要的作用。病毒和细菌等病原体感染会改变肺部的免疫状态。然而,由细菌引起的慢性炎症对肺内转移前生态位形成的影响尚不清楚,特异性免疫介质在肿瘤转移中的作用也在很大程度上仍不确定。
近日,中国科学院大学研究团队与川大华西医院研究团队在《Signal Transduction and Targeted Therapy》上发表题为“Chronic pulmonary bacterial infection facilitates breast cancer lung metastasis by recruiting tumor-promoting MHCIIhi neutrophils”的研究报告。在本研究中,研究人员使用的小鼠模型表明,慢性肺部细菌感染通过将一种具有促癌特性的肿瘤浸润MHCIIhi中性粒细胞亚型招募到肺部来增强乳腺癌的肺转移。功能上,MHCIIhi中性粒细胞通过细胞内在途径促进乳腺癌肺转移。此外,研究人员发现肺组织中的CCL2是招募和维持MHCIIhi中性粒细胞的重要环境信号。研究结果清楚地将细菌-免疫交互作用与乳腺癌肺转移联系起来,并确定MHCIIhi中性粒细胞是慢性感染和肿瘤转移之间的主要中介。

https://www.nature.com/articles/s41392-023-01542-0
研究背景
01
乳腺癌是一种高度恶性的肿瘤类型,肺转移是乳腺癌患者死亡的重要原因。乳腺癌肺转移的发生与应激、肥胖、吸烟等多种因素引起的慢性炎症密切相关。乳腺癌等多种肿瘤患者受到肿瘤细胞的困扰,常遭受放化疗引起的免疫损伤。肿瘤患者免疫防御能力减弱,易发生病原菌引起的慢性肺部感染。因此,病原菌引起的慢性炎症与乳腺癌转移的关系具有重要的研究意义。
铜绿假单胞菌是最常见的致病菌之一,可引起急性和慢性呼吸道感染,本研究通过经气管注射琼脂微球建立了一种广泛应用的慢性肺部感染(CI)小鼠模型。通过利用细胞飞行时间测定(CyTOF)来表征慢性感染肺组织的免疫细胞状态,我们发现了一个独特的MHCIIhi中性粒细胞群体。CCL2募集的MHCIIhi中性粒细胞在体外和体内均表现出促癌功能。这些结果表明,MHCIIhi中性粒细胞可能是肺转移的潜在治疗靶点,以改善晚期癌症患者的管理。
研究成果
02
MHCIIhi中性粒细胞在体内外均表现出促癌功能
通过流式分选技术从荷瘤小鼠体内分离中性粒细胞,比较MHCIIhi中性粒细胞和MHCIIlow中性粒细胞的功能。我们首先进行了Transwell实验,以研究MHCIIhi和MHCIIlow中性粒细胞对肿瘤细胞迁移的影响。我们的结果表明,MHCIIhi和MHCIIlow中性粒细胞均可促进肿瘤迁移。与MHCIIlow中性粒细胞相比,MHCIIhi中性粒细胞对肿瘤迁移的影响更强。然而,MHCIIhi和MHCIIlow中性粒细胞在肿瘤侵袭中的作用没有显著差异,并且在Transwell小室实验中,与空白对照组相比,两种中性粒细胞都促进了肿瘤的侵袭。此外,我们的中性粒细胞RNA-seq数据显示,MHCIIhi中性粒细胞高表达ROS相关基因。由于活性氧(ROS)可以驱动多种原癌性炎症反应,我们通过流式细胞术检测了MHCIIlow和MHCIIhi中性粒细胞的细胞内ROS生成能力。虽然两种中性粒细胞都能产生ROS,但MHCIIhi中性粒细胞比MHCIIlow中性粒细胞产生更多的ROS。尽管中性粒细胞转录组结果表明,与MHCIIlow中性粒细胞相比,MHCIIhi中性粒细胞具有活跃的促肿瘤增殖作用,但通过分别将4T1细胞与这两种中性粒细胞共培养,我们在体外实验中未发现两种中性粒细胞类型之间的显著差异。
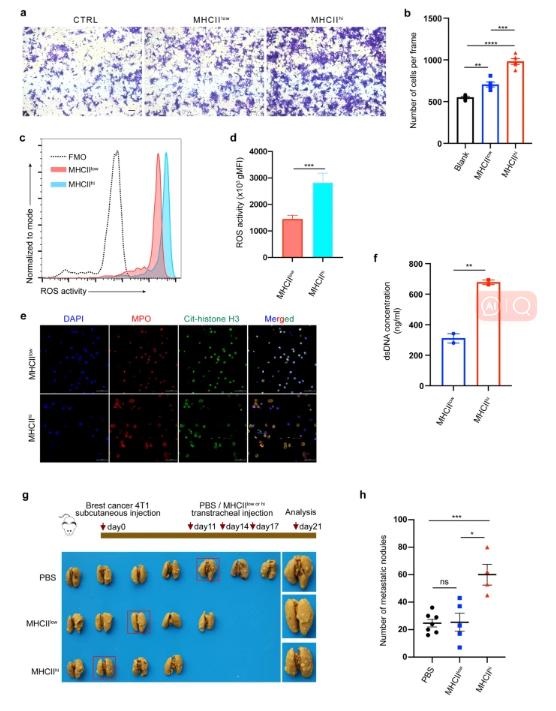
MHCIIhi中性粒细胞在体内外均表现出促肿瘤功能
研究意义
03
综上所述,研究结果揭示了慢性细菌感染可以通过趋化因子CCL2将MHCIIhi中性粒细胞招募到转移前肺,从而促进乳腺癌肺转移。具体来说,考虑到免疫细胞作为关键的治疗靶点,我们的研究假设MHCIIhi中性粒细胞是有希望的癌症治疗候选细胞。鉴于CCL2诊断的便利性,CCL2有望成为乳腺癌肺转移的临床诊断标志物。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41392-023-01542-0
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发