重要发现! 中山大学揭示胃癌治疗新方案!联合治疗阳性胃癌
| 导读 | 中国的胃癌发病率以西北最高、东北及内蒙古次之、华东及沿海又次之、中南及西南最低,每年约有17万人死于胃癌,且每年还会新增2万以上的胃癌病人。 |
对于人表皮生长因子受体2 (HER2)阴性、局部晚期不可切除或转移的胃或胃食管结合部(mG/GEJ)腺癌患者,迫切需要一线治疗选择。CLDN18.2在正常胃细胞中表达,在恶性G/GEJ腺癌细胞中也有表达。GLOW(关闭入组)是一项全球性、双盲、3期研究,研究了唑贝妥昔单抗(靶向CLDN18.2的单克隆抗体)联合卡培他滨+奥沙利铂(CAPOX)作为CLDN18.2阳性、HER2阴性、不可切除的局部晚期或mG/GEJ腺癌的一线治疗。
近日,中山大学研究团队联合国内外研究人员在《nature medicine》上发表题为“Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial”的文章。文章指出,唑贝妥昔单抗组(72.8%)和安慰剂组(69.9%)治疗期间发生的≥3级不良事件相似。对于CLDN18.2阳性、HER2阴性、局部晚期不可切除或mG/GEJ腺癌患者,唑贝妥昔单抗联合CAPOX可能是一种新的一线治疗方案。

https://www.nature.com/articles/s41591-023-02465-7
研究背景
01
胃腺癌是全球第五大最常见的癌症,在过去几十年中,胃食管结合部腺癌的发病率显著增加。由于早期疾病患者通常无症状,因此胃或胃食管结合部(G/GEJ)腺癌被诊断时常常处于晚期或转移期。这些癌症有一些最高的医疗需求未得到满足。HER2阴性、局部晚期不可切除或转移性G/GEJ (mG/GEJ)腺癌患者的标准一线治疗是铂类-氟嘧啶化疗;亚叶酸+ 5-氟尿嘧啶+奥沙利铂(FOLFOX)和卡培他滨+奥沙利铂(CAPOX)都是公认的标准化疗方案,但口服方案在亚洲地区更方便和首选。接受以奥沙利铂为基础的标准双药方案的患者生存约1年。
靶向治疗或免疫治疗联合化疗可改善部分转移性疾病患者的总生存期(OS) 。曲妥珠单抗被批准用于约15%的HER2阳性乳腺癌患者。纳武利尤单抗靶向程序性死亡受体-1 (PD-1)已在50多个国家被批准作为一线治疗;疗效主要局限于程序性死亡受体配体1 (PD-L1)合并阳性评分(CPS)≥5分的患者,约有20-60%的患者出现这一情况。在一些国家,雷莫芦单抗(ramucirumab)靶向血管内皮生长因子受体2已被批准单独或与紫杉醇联用作为二线治疗。对于HER2阴性、不可切除的局部晚期或mG/GEJ腺癌患者,我们仍然需要开发其他靶向疗法。
GLOW是一项全球性、随机、双盲、3期研究,在CLDN18.2阳性、HER2阴性、局部晚期不可切除或mG/GEJ腺癌患者中,评估了唑贝妥昔单抗联合CAPOX一线治疗的疗效和安全性,并与安慰剂联合CAPOX进行了比较。
研究过程
02
患者和治疗
2018年11月28日至2022年2月18日,在18个国家的166个研究中心筛查了总共2,333例未经治疗的局部晚期不可切除或mG/GEJ腺癌患者。我们在2,104例患者中评估了CLDN18.2肿瘤状态,其中808例(38.4%)的肿瘤达到了CLDN18.2阳性的临界值(≥75%的肿瘤细胞有中至强CLDN18膜染色,这是通过使用试验性VENTANA CLDN18 (43-14A) RxDx检测法进行的中央免疫组化确定)。在接受CLDN18.2状态评估的患者中,1,701例患者的肿瘤为HER2阴性;1,701例患者中的729例(42.9%)肿瘤达到了CLDN18.2阳性的临界值。在接受筛查的HER2阴性且符合CLDN18.2阳性临界值的肿瘤患者中,222例因不符合其他纳入标准或患者决定退出研究而未被随机分组。最终,在131个研究中心,507例CLDN18.2阳性肿瘤患者被随机分组,分别接受唑贝妥昔单抗+ CAPOX治疗(n = 254,以下简称“唑贝妥昔单抗”)或安慰剂+ CAPOX治疗(n = 253,以下简称“安慰剂”)。招募期从2019年1月21日(随机分配的第1例患者)至2022年2月18日(随机分配的最后1例患者)。在2022年10月7日数据截止时,在随机分配接受唑贝妥昔单抗和安慰剂治疗的患者中,中位试验随访时间分别为PFS 12.62个月和12.09个月,OS 17.71个月和18.43个月。两组的人口统计学和基线特征总体平衡。作为一项专门分析,我们利用Dako PD-L1 IHC 28-8 pharmDx检测法评估了随机分组的患者子集的PD-L1表达,这些患者的同意样本可用于检测。288例患者中的225例(78.1%)被确定患PD-L1 CPS <5的肿瘤。
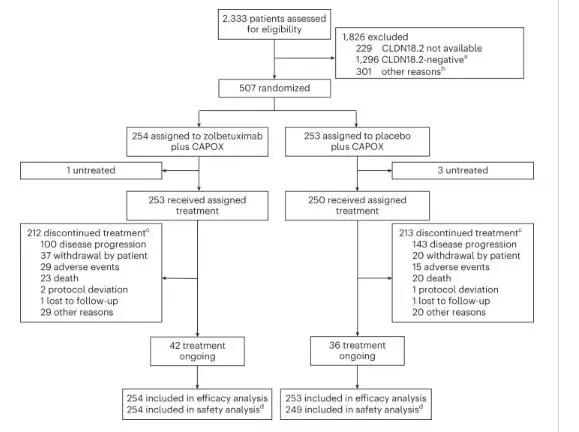
GLOW研究的CONSORT图
研究结果
03
本研究有一些局限性。首先,本研究的统计学功效不足以在预设的亚组中确定唑贝妥昔单抗联合CAPOX的疗效。在所有病例中,这些亚组均相对较小,因此应谨慎解读。其次,本研究未评估唑贝妥昔单抗与纳武利尤单抗联合治疗。化疗被选择作为GLOW研究的相关对照,因为在研究开始时,纳武利尤单抗尚未被批准用于该患者人群。此外,在这一人群中,有相当数量的患者对纳武利尤单抗无应答。ILUSTRO研究(NCT03505320)目前正在CLDN18.2阳性、HER2阴性、局部晚期不可切除或mG/GEJ腺癌患者中评估唑贝妥昔单抗靶向CLDN18.2联合纳武利尤单抗靶向PD-1联合化疗作为一线治疗的疗效和安全性。
总体而言,在CLDN18.2阳性、HER2阴性、局部晚期不可切除或mG/GEJ腺癌患者中,与安慰剂联合CAPOX治疗相比,唑贝妥昔单抗联合CAPOX治疗显著延长了PFS和OS。这些结果进一步证实了3期SPOTLIGHT研究中观察到的生存获益。总之,这些研究支持考虑对CLDN18的肿瘤表达进行生物标志物检测,以及在根据生物标志物选择的患者人群中,将唑贝妥昔单抗作为一线治疗联合化疗作为潜在的新标准治疗。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41598-023-38431-z
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发