【Nature子刊】浙江大学团队发现可提高抗癌免疫力的新策略
| 导读 | 通常免疫抑制的肿瘤微环境(TME)可能会阻碍免疫逃避和对检查点阻断疗法的反应。STING通路的药理学激活确实会产生免疫学上的热TME,然而,全身递送可能导致产生不被希望的脱靶炎症反应。 |
7月31日,浙江大学王杭祥团队在《Nature Communications》上发表题为“Chemically programmed STING-activating nano-liposomal vesicles improve anticancer immunity”的研究论文,研究结果为低效STING激动剂的重新利用和结构优化提供了一个概念验证,以产生全身可注射的高效纳米治疗药物,以解决其免疫逃逸机制。

https://www.nature.com/articles/s41467-023-40312-y
研究背景
使用免疫检查点阻断(ICB)抑制剂(例如抗PD-1 / PD-L1和抗CTLA-4抗体)的癌症免疫治疗取得了显著的临床成功,在多种癌症类型中产生了持久和长期的治疗反应。然而,只有一小部分患者从这种治疗中受益。许多难以接近的肿瘤具有免疫学上的低温,其特征是免疫抑制因子的大量浸润,同时没有肿瘤浸润淋巴细胞,从而使它们能够逃脱免疫监视。因此,大多数癌症对美国食品和药物管理局批准的ICB抗体表现出压倒性的新生难治性。因此,除了直接针对适应性免疫应答的方法之外,迫切需要有效的免疫治疗方法有望使大量癌症患者受益。
干扰素基因刺激物(STING)是一种细胞内信号传导受体,可调节先天免疫途径,对于启动抗肿瘤免疫至关重要。STING 通过内源性环二核苷酸 (CDN) 的药理学激活,例如 2′,3′–环鸟苷单磷酸腺苷 (cGAMP),这促使诱导 I 型干扰素 (IFN) 和其他促炎细胞因子。这进一步刺激树突状细胞(DC)活化和肿瘤抗原的交叉呈递,逆转肿瘤免疫荒漠化。大量的努力集中在开发模仿内源性cGAMP15,16,17的CDN衍生物上。然而,由于代谢不稳定和全身给药后快速清除,这些激动剂的疗效受到很大损害。
上述挑战促使人们研究STING激活系统,以传导和快速扩展其免疫治疗试验以对抗癌症。MSA-2是一种最近开发的非核苷酸STING激活激动剂。该药物已在动物研究中口服给药,尽管口服生物利用度低和胞质进入不足可能会限制其抗肿瘤功效。我们假设MSA-2分子上的羧基部分(10-OH)可能是其与药物载体相容性差的原因,并且可以通过合理的化学衍生化来改善。
研究进展
在本研究中,我们开发了STING激活脂质体囊泡,其捕获工程MSA-2前药以利用先天抗肿瘤免疫。这些吗啉(MP)型前药实体的药物活化动力学通过不同的烃数进行调节,从而允许选择能够快速释放活性药物以进行有效STING活化的候选药物。我们揭示了工程化STING激动剂前药脂质体(SAProsomes)的非常强大的结构-活性关系,使其在适应性配方和体内抗肿瘤功效方面能够进行优化。值得注意的是,在给予三阴性乳腺癌4T1和黑色素瘤癌症B16F10模型(ICB治疗基本上难治)时,SAProsome引发抗肿瘤免疫,已建立肿瘤的持久缓解,术后无肿瘤生存和抑制转移负担。因此,这项研究强调了通过脂质体递送优化的STING前药作为提高抗肿瘤免疫力的有希望的治疗方法的潜力。
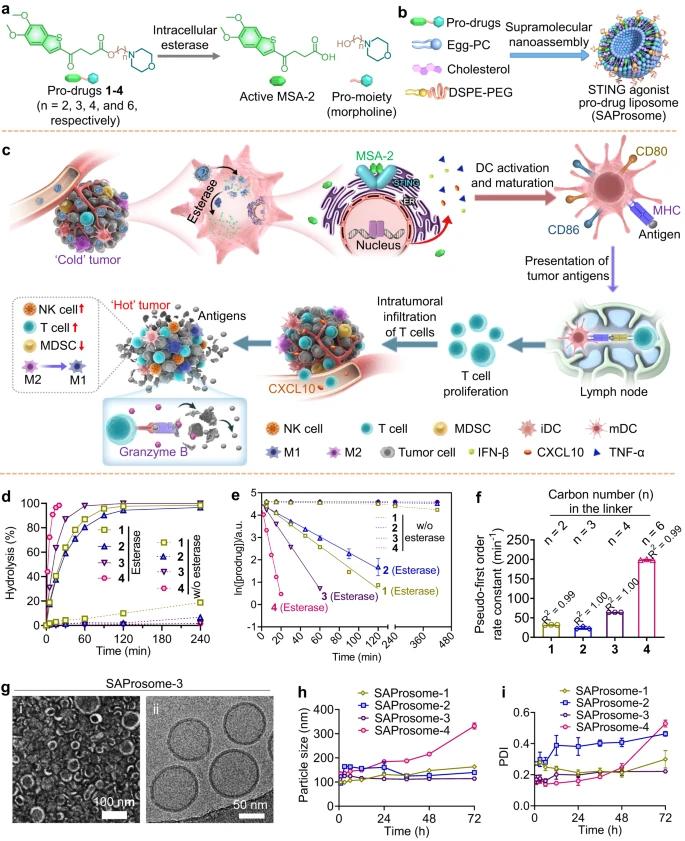
干扰素基因(STING)激活脂质体囊泡(SAProsomes)的刺激剂,用于增强抗癌免疫力。
脂质体制剂STING激活前药的合理设计
最近发现的非核苷酸STING激动剂MSA-2被选中来测试我们药物设计的有效性。为了促进MSA-2的脂质体配方的开发,我们最初使用不同长度的MP型链烷醇作为改性剂,通过酯键构建了四种合成MSA-2衍生物(化合物1-4),然后,使用质子核磁共振和高分辨率质谱法明确证实了它们的化学结构。我们试图通过使用MP的化学衍生化来降低MSA-2上羧基的极性,以使前药物有效地组装成脂质体纳米囊泡。酯键易受酯酶催化的肿瘤水解作用,从而能够原位释放化学未修饰的激动剂用于STING活化。然后,我们研究了酯酶触发的MSA-2被前药激活的机理。MSA-2前药在猪肝酯酶(PLE)存在下表现出可调和接头长度依赖性水解动力学。尽管所有前体药物均在37 °C磷酸盐缓冲液(PBS)缓冲液中耐水解,但大多数前体药物(~90%)在体外酯酶存在下30 min内转化为化学未修饰的STING激动剂。这些前药释放STING激动剂的伪一级速率常数(± s.d.)分别为31.9±0.3×10−3分钟−1(前药1)、23.9±3.5×10−3分钟−1(前药2)、64.1±0.2×10−3分钟−1(前药3)和199.1±1.2×10−3分钟−1(前药4)。
接下来,我们测试了这些MSA-2前药组装成脂质体纳米囊泡(SAProsomes)的能力。母体MSA-2分子不与脂质体组分混溶,仅在水溶液中产生沉淀物。相反,遵循纳米沉淀方案,MSA-2前药1-4与脂质体成分高度相容,对不同前药的负载效率为>90%。这些前体载药纳米颗粒形成了典型的纳米脂质体结构,通过透射电子和冷冻电子显微镜观察证明了这一点。此外,这些SAProsomes表现出合适的z平均直径~120 nm(通过动态光散射测量)和窄尺寸分布(如低多分散指数所反映)。除SAProsome-4外,所有SAProsomes在含有血清(20%,w / v)的缓冲溶液中保持足够稳定。
研究意义
虽然 STING 激动剂的瘤内给药可减轻全身毒性,但该给药途径仅限于实体可及肿瘤患者。我们的实验结果为低效STING激动剂的重新利用和结构优化提供了一个概念验证,以产生全身可注射的高效纳米治疗药物,以解决其免疫逃逸机制。此外,鉴于在实验中观察到的前药3的口服活性显着改善,可以设想通过口服给药使用该化合物的迅速疗效评估。安全性评估后,有必要进行前瞻性临床试验,以单独或与其他免疫疗法联合研究优化的STING激活脂质体。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-40312-y
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发