《npj Precision Oncology》慕尼黑大学建立帮助优化结直肠癌治疗的全新模型
| 导读 | 早发性结肠直肠癌(EO-CRC,50岁以下的患者)的发病率在全世界范围内不断增加。EO-CRC患者的特定基因特征在很大程度上是未知的。在这里,我们证明具有微卫星稳定的早发性结肠直肠癌(MSS-EO-CRC)与晚发的MSS CRC(MSS-LO-CRC)具有类似的肿瘤浸润免疫细胞、免疫治疗反应、共识分子亚型和预后的模式。总的来说,MSS-EO-CRC表现出与MSS-LO-CRC不同的分子图谱,尽管它们具有相似的TME特征和生存模式。我们的风险评分似乎足够强大,可以预测预后和免疫治疗反应,因此可以帮助优化MSS-EO-CRC的治疗。 |
7月1 日,来自慕尼黑大学的Florian Kühn团队在《npj Precision Oncology》上发表了名为“Molecular characteristics of microsatellite stable early-onset colorectal cancer as predictors of prognosis and immunotherapeutic response”的研究文章,论文建立了一个风险评分,该评分与程序化死亡配体1(PD-L1)的表达呈正相关,可以反映肿瘤浸润性免疫细胞的水平和MSS-EO-CRC患者的预后情况和免疫治疗反应。

https://www.nature.com/articles/s41698-023-00414-8
研究背景
大肠癌(CRC)是全球第三大确诊的癌症,也是癌症相关死亡的第二大原因。尽管在过去20年里,大多数西方国家诊断为50岁或以上患者的晚发性CRC(LO-CRC)的发病率已稳步下降,但在全球范围内,诊断为50岁以下患者的早发性CRC(EO-CRC)病例却惊人地增加。据估计,到2030年代,EO-CRC将占直肠癌的四分之一和结肠癌的10-12%。到目前为止,EO-CRC上升趋势的根本原因尚不清楚。
累积的研究报告显示,与LO-CRCs相比,EO-CRCs往往具有更晚的TNM(肿瘤-结节-转移)分期,左侧癌和分化不良的肿瘤发生率更高,微卫星不稳定-高(MSI-H)状态的比例更高,以及更多的种系突变。人们已经做了大量的努力来描述EO-CRCs的体细胞突变特征,但未能发现以前未知的改变来阐明这些癌的发病机制或指导临床治疗,EO-CRCs的独特转录特征仍然难以捉摸。越来越多的证据表明,大多数具有MSI-H的EO-CRCs与林奇综合征有关。关于林奇综合征中众所周知的错配修复(MMR)基因的种系突变,我们打算确定其发生微卫星稳定的EO-CRCs(MSS-EO-CRC)的潜在分子机制。
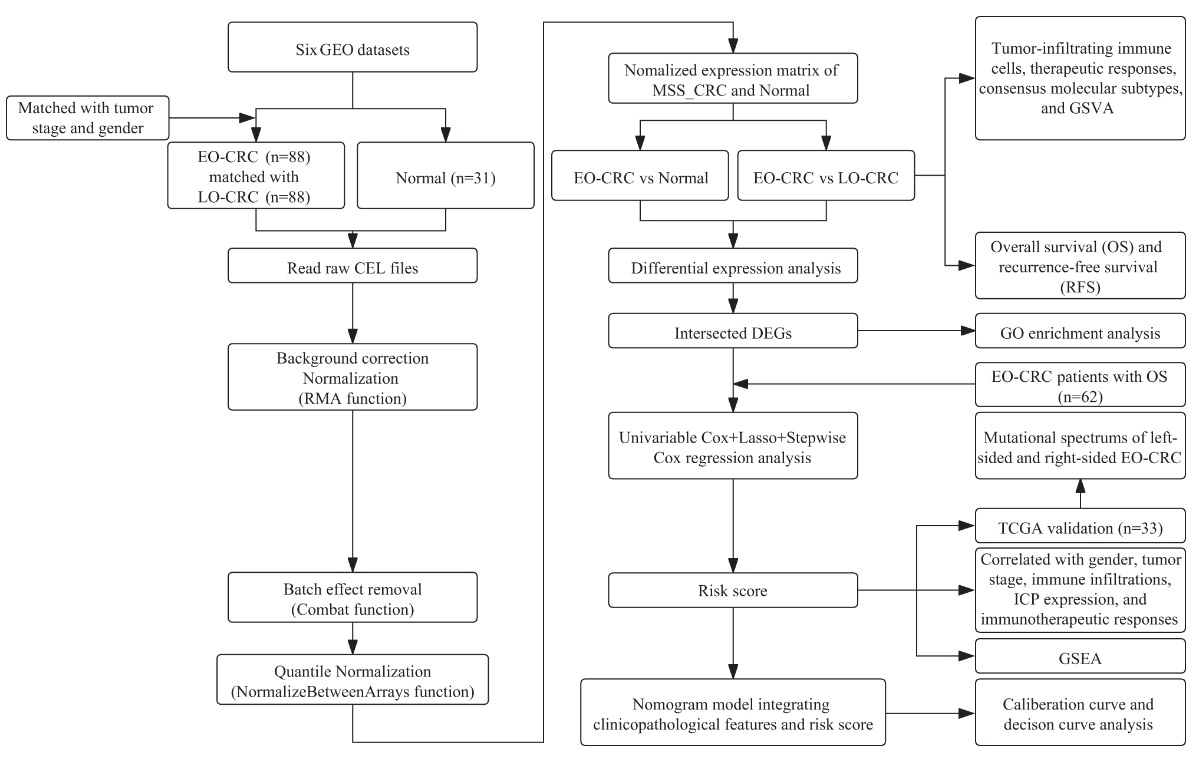
我们系统地整合了多种转录谱,用以评估MSS-EO-CRC与带有MSS的LO-CRC(MSS-LO-CRC)相比的特征。此外,我们描述了MSS-EO-CRC不同侧面的遗传变异和内源性生长因子受体(EGFR)相关分子的表达。
研究过程
我们首先证明了MSS-EO-CRC患者的肿瘤浸润免疫细胞和基质成分的组成与MSS-LO-CRC患者相似。这一发现与Ugai等人发表的数据一致,后者显示MSS-EO-CRC和MSS-LO-CRC患者的9个T细胞亚群、3个巨噬细胞亚型和8个骨髓细胞亚群的比例相当。同时,这两个CRC队列对免疫检查点(ICP)抑制剂也有相同的反应率。由于我们的研究中只包括MSS的CRC患者,这些受试者大多对免疫单药治疗难治,这主要是由肿瘤浸润淋巴细胞水平低和肿瘤突变负担造成的。根据达成共识的分子亚型(CMSs)的分类,我们的研究显示,CMS2是MSS-EO-CRC和MSS-LO-CRC患者的主要分子亚型。相反,一项临床研究表明,EO-CRC与LO-CRC的CMS2组成相当,但也明确显示CMS1是EO-CRC中最常见的亚型。这种差异主要是由于MSS状态的不同纳入标准造成的。此外,我们证明MSS-EO-CRC患者的总生存率(OS)和无复发生存率(RFS)与MSS-LO-CRC相似,这与多项研究一致。因此,MSS-EO-CRC患者具有类似的TME情况,与MSS-LO-CRC患者的生存期相当。
通过更深入地了解EO-CRC和LO-CRC之间不同的潜在肿瘤发生机制,我们发现EO-CRC患者比LO-CRC有更强的Wnt信号激活。一致的是,我们的研究描绘了mTOR信号通路和Wnt信号通路可能在促进MSS-EO-CRC的进展中发挥了更重要的作用。众所周知,Wnt和mTOR通路在促进癌症的进展中起着关键作用。因此,MSS-EO-CRC患者可能比MSS-LO-CRC患者对Wnt或mTOR靶向药物更敏感。此外,133个二基因组被确定为MSS-EO-CRC队列的独特基因特征。生物富集分析表明,这些基因与癌细胞的有丝分裂有关。以前的研究报告指出,有丝分裂调节功能的丧失可通过细胞周期失调和异常增殖导致癌症的发生。另外,一些与有丝分裂相关的分子参与了癌症的发生和转移,包括CRC。因此,确定的基因组可能通过调节有丝分裂参与MSS-EO-CRC的发展和进展。这些结果表明,与MSS-LO-CRC相比,MSS-EO-CRC具有不同的分子机制和基因表达模式。
同时,与MSS-LO-CRC和对照组相比,MSS-EO-CRC的WASF1表达最高,肿瘤坏死因子受体超家族14(TNFRSF14)最低。我们的研究还证明,WASF1在MSS-EO-CRC患者中具有不利的作用,而TNFRSF14似乎是一个保护因素。WASF1也被称为WAVE1,可以激活肌动蛋白相关蛋白2/3复合物,引起肌动蛋白聚合。由于肌动蛋白细胞骨架在介导癌细胞向血液或淋巴系统迁移中的关键作用,WASF1在癌症转移和侵袭中具有重要作用。许多研究报道,WASF1的下调可以显著抑制前列腺癌和卵巢癌的进展和侵袭,促进抗药性诱导的白血病细胞凋亡。有报道称,WASF1的耗竭可以通过PI3K/AKT和p38/MAPK信号途径降低上皮性卵巢癌(EOC)的增殖和侵袭能力。另外,WAVE1的表达升高与EOC的预后恶化有关,这与我们的发现一致。然而,暂时没有研究描述了WASF1在CRC中的生物学功能。TNFRSF14,也被称为肿瘤坏死因子受体超家族14,编码受体HVEM,激活免疫细胞上的共刺激或共抑制信号通路。它在淋巴细胞和骨髓系细胞中表达,在内皮细胞和脂肪细胞中高度表达。TNFRSF14/BTLA与PD-L1/PD-1有类似的抑制作用,可减弱T辅助细胞的激活。我们的研究表明,TNFRSF14表达较高的MSS-EO-CRC患者比表达较低的患者具有更好的OS。因此,WASF1和TNFRSF14有可能参与到MSS-EO-CRC的发展和进展中。
(研究流程图)
研究意义
这是第一个提出基于MSS-EO-CRC患者基因表达谱的预后模型的研究。我们的风险评分与MSS-EO-CRC的肿瘤浸润免疫细胞有关,对患者的预后有可靠的预测。人们普遍认为,有T细胞浸润和PD-L1在实质上表达的肿瘤更有可能获得ICP抑制剂的临床反应。这里,风险评分已被证明能反映MSS-EO-CRC中TME的这种特征。通过对转移性尿道癌的抗PD-L1治疗队列应用该评分,我们发现低风险评分组与免疫炎症表型和较高的CD8+T细胞浸润有关,因此,预后更好,反应率更高。此外,我们根据风险评分和肿瘤分期构建了提名图模型来预测MSS-EO-CRC患者的生存率。我们还证明,该模型相比单独的风险评分或肿瘤分期,能提供更可靠的预测。因此,风险评分和模型可有助于评估MSS-EO-CRC患者的预后和免疫治疗反应。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41698-023-00414-8
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发