【Nature子刊】医校联动!哈佛大学医学院/西安交通大学第一附属医院发现癌症免疫治疗新靶点
| 导读 | 导读:cGAS/STING固有免疫通路的激活对于抗肿瘤免疫治疗至关重要且有效。然而,肿瘤固有的cGAS信号是如何被抑制,从而通过逃避免疫监视促进肿瘤发生的,这在很大程度上仍然是未知的。本研究发现蛋白质精氨酸甲基转移酶PRMT1可以使cGAS在保守的Arg133位点发生甲基化,从而阻止cGAS的二聚化并抑制癌细胞中cGAS/STING信号通路。 |
近日,哈佛大学医学院联合西安交通大学第一附属医院研究人员共同在国际知名期刊《Nature Communications》上发表了一篇题为“PRMT1 mediated methylation of cGAS suppresses anti-tumor immunity”的论文,该研究报道了蛋白精氨酸甲基转移酶PRMT1在保守的Arg133残基上甲基化cGAS,从而阻止cGAS二聚化并抑制癌细胞中的cGAS/STING信号传导。
值得注意的是,基因或药物消融PRMT1会激活cGAS/ sting依赖的DNA传感信号,并显著提高I型和II型干扰素应答基因的转录。因此,PRMT1抑制以cGAS依赖的方式提高肿瘤浸润淋巴细胞,并促进肿瘤PD-L1的表达。PRMT1抑制剂与抗pd -1抗体联合治疗可增强体内抗肿瘤治疗效果。所以,本研究将PRMT1/cGAS/PD-L1调控轴定义为决定免疫监视疗效的关键因素,这是提高肿瘤免疫的一个有希望的治疗靶点。

https://www.nature.com/articles/s41467-023-38443-3#Sec10
研究背景
01
cGAS/STING信号在肿瘤细胞和免疫能力小鼠中的存在对于抗肿瘤免疫至关重要,而在肿瘤细胞或免疫能力小鼠中cGAS和/或STING的缺失会严重抑制肿瘤的免疫原性和免疫治疗的效率。另一方面,在同基因小鼠模型中,cGAMP或STING激动剂与免疫检查点阻断(ICBs)协同作用。此外,破坏DNA损伤修复以提高胞质DNA水平的疗法,如PARP抑制剂、CHK1抑制剂和ATM抑制剂,部分通过激活cGAS/STING途径与抗肿瘤免疫疗法协同作用。
值得注意的是,cGAS的翻译后修饰,包括泛素化,乙酰化和磷酸化,已被报道可以调节其在免疫细胞和癌细胞中的酶活性。然而,肿瘤内cGAS/STING信号如何被抑制以促进癌细胞的免疫逃逸仍是未知的。人类蛋白质存在三种不同类型的精氨酸甲基化,即单甲基精氨酸(MMA)、不对称二甲基精氨酸(ADMA)和对称二甲基精氨酸(SDMA)。蛋白质精氨酸甲基化在负调控抗病毒应答中发挥重要作用,但仍存在争议。PRMT1是主要的I型PRMT,它负责超过90%的ADMA,这种修饰经常发生在DNA和RNA结合蛋白中,如Histone和CHTOP。然而,对于PRMT1是否以及如何调控cGAS活性仍然知之甚少。最近的研究表明,抑制PRMT1可以诱导人三阴性乳腺癌(TNBC)细胞的病毒模拟反应,但其是否干扰cGAS/STING信号通路以及如何干扰cGAS/STING信号通路仍不清楚。
研究过程
02
研究人员推测PRMT1可能通过介导cGAS精氨酸甲基化来调节固有免疫。为了验证这一假设,研究人员在缺乏内源性cGAS和STING表达的HEK293T细胞中共转染HA-cGAS和gfp - prmt,以避免下游炎症信号传导。

PRMT1 甲基化 cGAS 并抑制 cGAS/STING DNA 传感信号
为了进一步探究PRMT1介导的cGAS甲基化是否以及如何影响癌细胞中cGAS依赖的DNA传感信号,我们建立了稳定过表达PRMT1的HeLa细胞系,发现PRMT1过表达显著抑制细胞的DNA传感,表现为在DNA刺激(包括HT-DNA和ISD45)后,STING和IRF3的磷酸化降低。
为了进一步确定PRMT1在控制cGAS/STING信号传导中的作用,研究人员使用shRNA去除内源性PRMT1,发现PRMT1的基因缺失以时间依赖性的方式激活了HeLa细胞中的cGAS/STING/IRF3信号传导。
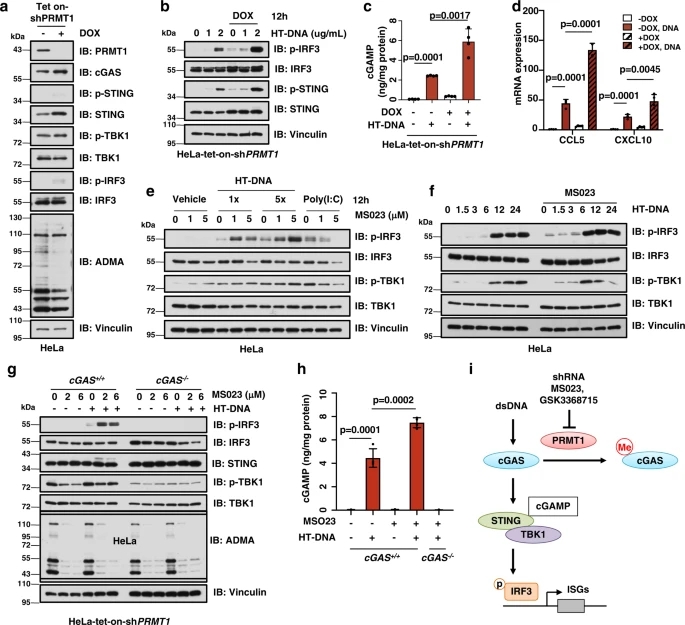
PRMT1 的基因消融或药物抑制导致 cGAS/STING 信号激活
在cGAS的N端有两个保守的精氨酸残基,Arg-71 (R71)和Arg-75 (R75),它们是cGAS锚定在质膜上的关键。因此,研究人员通过体内甲基化实验测试了R71/75在prmt1介导的甲基化中的潜在作用。由于cGAS/STING通路对抗肿瘤免疫至关重要,研究人员进一步确定了PRMT1是否是免疫治疗的合理靶点。
接下来,研究人员确定了PRMT1在体外和体内肿瘤免疫监测中的因果作用。为了进一步探索PRMT1作为免疫治疗靶点的潜力,研究人员进一步用PRMT1抑制剂MS023和GSK3368715处理CT26细胞,并对这些样本进行RNA测序。
为了证明PRMT1通过体内cGAS的甲基化对癌症免疫监视的抑制作用,研究人员在用PRMT1抑制剂MS023处理CT26-cGAS-WT或CT26-cGAS-KO细胞后,在同种小鼠模型中测量了免疫细胞的浸润。
为了研究PRMT1如何调节PD-L1的表达,研究人员接下来生成了多个小鼠肿瘤细胞,包括CT26、MC38、4T1和B16,这些细胞稳定表达了可诱导的shPrmt1,并发现在这些小鼠肿瘤细胞中,强力霉素诱导PRMT1敲低后,mPD-L1的表达显著升高。
鉴于 PRMT1 在人和小鼠肿瘤细胞中的 cGAS 依赖性 DNA 传感信号和免疫抑制中的关键作用,研究人员接下来检查了 PRMT1 作为癌症免疫治疗靶标的潜力。与同基因肿瘤模型的结果一致,只有在人类癌症患者(包括COAD、AML、淋巴瘤和胶质瘤)中PRMT1表达水平较低时,较高的细胞毒性T淋巴细胞(ctl)浸润才能预示更好的预后。
最后,研究人员比较了CT26-cGAS-WT和CT26-cGAS-KO同基因肿瘤模型对PRMT1抑制剂和抗pd -1抗体联合治疗的响应性。
研究意义
03
综上,本研究证明了蛋白质精氨酸甲基转移酶PRMT1在抑制cGAS/STING信号传导中起关键作用,PRMT1通过甲基化cGAS在其N端保守的Arg133残基。因此,PRMT1是肿瘤免疫治疗的潜在靶点,PRMT1抑制剂与免疫检查点抑制剂协同提高肿瘤免疫。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-38443-3#Sec10
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发