【新发现】乳腺癌的福音——细胞分裂的“变阻器”TRIM37 的发现
| 导读 | 人类染色体主要由携带基因的脱氧核糖核酸(DNA)双链螺旋构成,基因不稳定可造成细胞有丝分裂失控而疯狂生长,这是癌细胞的重要标志之一,并且对乳腺癌的发生和发展具有关键作用。近日,全球自然科学三大旗舰期刊之一、英国《自然》正刊发表英国牛津大学、伦敦大学癌症研究院、伦敦大学国王学院、美国霍普金斯大学的研究报告,探讨了基因不稳定所致乳腺癌的关键机制及其靶向治疗策略。 |
同源重组是修复DNA的主要机制,多腺苷二磷酸核糖聚合酶(PARP)抑制剂可有效治疗DNA同源重组修复功能缺陷的乳腺癌。不过,DNA同源重组修复功能缺陷仅存在于一部分乳腺癌,故有必要明确基因不稳定所致乳腺癌的其他机制及其靶向治疗策略。最近,研究人员发现:细胞分裂的“变阻器”TRIM37,有望为乳腺癌的细胞中心体靶向治疗做贡献。
该项研究于9月9日发表在《Nature》上,题为:“Targeting TRIM37-driven centrosome dysfunction in 17q23-amplified breast cancer”。

TRIM37基因所在的17号染色体长臂第2区第3条带(17q23)扩增可见于大约10%的乳腺癌,此类乳腺癌对PLK4抑制剂高度敏感。灭活TRIM37可促进不需细胞中心体的细胞有丝分裂,因为TRIM37可阻止PLK4形成凝聚体,催化组装不需要细胞中心体的纺锤体。相反,TRIM37高表达通过降解分子量为192千道尔顿的细胞中心体蛋白质(CEP192)可抑制细胞中心体组装纺锤体,故TRIM37是细胞有丝分裂对PLK4抑制剂敏感性的重要决定因素。
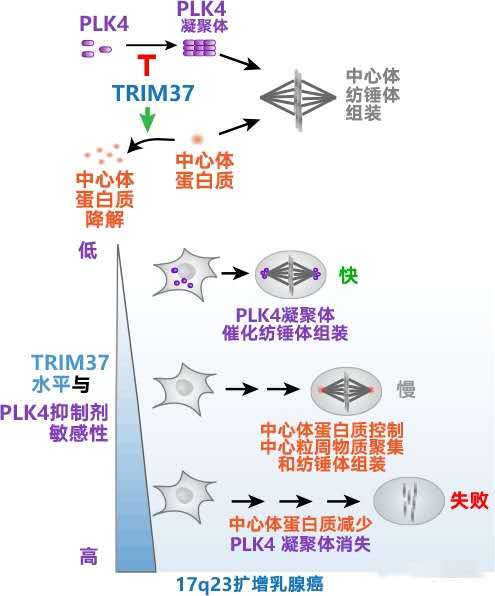
图2 抑制PLK4后TRIM37对非中心体型有丝分裂进行双向控制的模型
调节细胞有丝分裂的细胞中心体如果被耗尽,可诱发17q23扩增癌细胞死亡,17q23扩增是基因拷贝数畸变的常见原因,并与基因不稳定程度密切相关。利用PLK4小分子抑制剂可引起细胞中心体耗尽,从而触发TRIM37过表达细胞有丝分裂期死亡。TRIM37可抑制细胞中心体的中心粒周物质,对于缺乏细胞中心体的17q23扩增细胞,TRIM37过表达可阻止中心粒周物质聚集,从而阻止细胞微管构成纺锤体,最终阻止细胞有丝分裂。此外,TRIM37过表达可延迟细胞中心体成熟并分离进入细胞有丝分裂,从而增加有丝分裂错误率,引起基因不稳定。
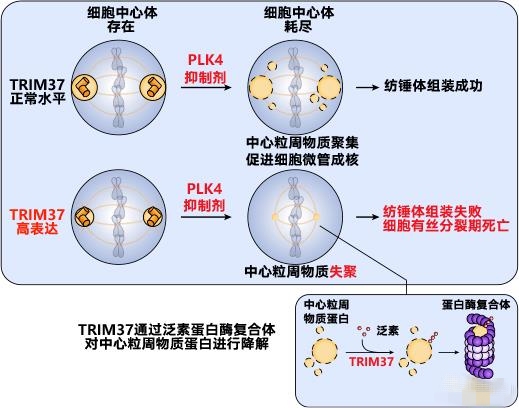
图3 17q23扩增的乳腺癌细胞中PLM4抑制与TRIM37过表达的合成致死作用模型
停止细胞分裂是治疗癌症的合理思路,其他研究小组也正在追求。牛津大学,乌普萨拉大学和卡罗林斯卡研究所的科学家最近进行的一项研究发现,关闭一种叫做DHODH的酶可以阻止癌细胞分裂。
参考资料:
1.https://www.fiercebiotech.com/research/blocking-tumor-cell-division-to-stop-breast-cancer
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发