【Nature】新发现:血脑屏障的破坏也是阿尔茨海默症的早期标志
| 导读 | 阿尔茨海默症一般是发生于老年人身上的一种脑变性疾病,因为其表现症状多为记忆力衰退、失去说话能力,所以很多人称阿尔茨海默症为老年痴呆症,但由于阿尔茨海默症的潜伏期特别长,所以很多人发现得了这种病的时候已经发展的比较严重了,所以早发现早治疗显得尤为重要。 |
阿尔茨海默症的广为人知的特点就是,在大脑中有错误折叠的淀粉样蛋白(Aβ)和tau蛋白肿块。然而,越来越多的人意识到,可能错误折叠的淀粉蛋白和tau蛋白不是全部,血脑屏障(BBB)的改变也是神经退行性疾病的早期标志。
血脑屏障的破坏程度与一个人经历的认知功能障碍程度有关,但导致血脑屏障损伤的原因还尚不清楚,蒙塔古(Montagne)等人在《自然》杂志上发表的文章指出:阿尔茨海默症主要遗传风险因素就是载脂蛋白E4,载脂蛋白E4与血脑屏障的破坏有关。

载脂蛋白E基因(APOE)编码了大脑中的一种主要的脂质转运蛋白ApoE。APOE有三个主要的变异体:APOE2,APOE3和APOE4,与几乎所有的基因一样,人们携带两个APOE拷贝,它们可能是同样的变体,也可能是不同的变体。与更常见的APOE3变体相比,APOE4明显增加患阿尔茨海默症的风险。携带一种APOE4变体的人患病风险可达4倍,携带两种APOE4变体的人患病风险可达15倍。携带APOE4的人如果患有阿尔茨海默症,也会比那些没有携带APOE4的人更早出现疾病的症状。
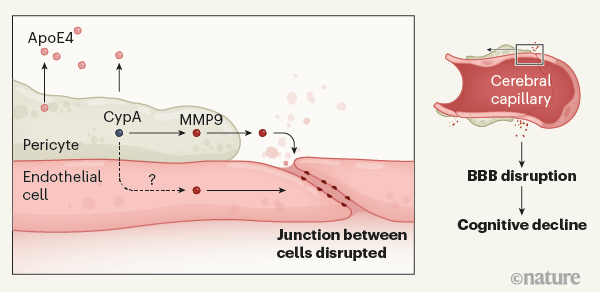
携带APOE4的认知健康人群的脑脊液(包围大脑和脊髓的液体)中发现了血浆中的蛋白质,这些人随后会发展为阿尔茨海默症。这些蛋白质据推测是通过血脑屏障泄露出来的,这表明在认知功能下降前,屏障的完整性就被破坏了。来自小鼠模型和死于阿尔茨海默症患者的大脑中获得的证据表明,血脑屏障的破坏是由周细胞(位于大脑的毛细血管壁中的细胞)退化引起的,周细胞通常通过防止构成内皮细胞(组成毛细血管壁的物质)连接破坏来保护血脑屏障。
是ApoE4自身导致早期阿尔茨海默症的血脑屏障障碍呢,还是它与Aβ和tau一起导致阿尔茨海默症的早期血脑屏障障碍还尚未明确,蒙塔古和他的同事开始着手解决这一知识缺口。研究人员根据人群的APOE状态分组,使用一种动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging)去调查有健康认知或轻度认知障碍(阿尔茨海默症的前奏)人群的血脑屏障的渗透性。研究发现,那些认知健康和携带一份或两份APOE4拷贝的人,在记忆和认知特别重要的两个大脑区域(海马体和海马旁回)血脑屏障中有一个漏洞。在表现出轻度认知能力下降的APOE4携带者中,这种情况更为严重。
很明显,这些影响早于海马体和海马旁回的任何组织缺损的迹象,证实了血脑屏障破坏是神经退化进程的一个早期的表达。血脑屏障的泄露与Aβ和tau集聚没有关系,研究人员通过研究脑脊液的样本和另一种脑成像技术正电子发射计算机断层扫描(positron-emission-tomography)来评估Aβ和tau集聚。蒙塔古和他的同事发现,与APOE4携带者不同的是,健康认知APOE3携带者的血脑屏障是完好无损的。然而,APOE3携带者即使显示出认知障碍,也比同等损伤阶段的APOE4携带者的血脑屏障好很多。
接下来,蒙塔古等人研究了APOE4携带者中的分解是否与周细胞变性有关,为了支持这一观点,研究人员发现与APOE3携带者相比,APOE4携带者脑脊液中的周细胞损伤生物标记物(已知的血小板源生长因子受体β(sPDGFRβ)的可溶性蛋白质)升高,携带APOE4的人体内高水平的蛋白质与血脑屏障泄露和认知障碍有关。sPDGFR升高与Aβ和tau无关。
研究人员寻找周细胞可能损伤的机制,他们专注于研究亲环蛋白A(CypA)和基质金属蛋白酶-9(MMP9),这两种蛋白是参与APOE4驱动的周细胞损伤和血脑屏障分解的炎症途径的一部分。轻度认知障碍的APOE4携带者的脑脊液中CypA和MMP9的水平高于认知功能正常的APOE4携带者和认知功能异常的APOE3携带者。再声明一次,这种变化和Aβ或tau的增长无关。
最后,研究人员在体外从表达APOE3或APOE4的人类诱导多潜能干细胞中产生周细胞,他们发现表达APOE4的周细胞比APOE3的周细胞分泌更多的CypA和MMP9,周细胞分泌的ApoE4(而不是ApoE3)激活了周细胞附近的CypA-MMP9通道,从而导致细胞自身死亡。ApoE4也能够激活内皮细胞中的CypA-MMP9通道,这一通道易受ApoE4的有害影响。因此,周细胞和内皮细胞的损伤可能导致血脑屏障的渗漏。
基因变异体APOE4与阿尔茨海默病
这些观察结果为APOE4提供了新的线索,这违背了人们普遍认为的这种基因变异只能通过促进Aβ和tau的集聚来导致阿尔茨海默症,相反,血脑屏障功能障碍可能解释了为什么APOE4携带者容易患上阿尔茨海默症。研究人员的发现可能也解释了为什么APOE4携带者在中风或创伤性脑损伤后的预后比携带其他APOE变异体的人员更差。然而,随着阿尔茨海默症的进展,APOE4能够使得Aβ和tau的清除率变慢,加剧了认知能力的下降。
更惊人的发现是,APOE4和APOE3携带者之间认知障碍的早期驱动因素存在差异。蒙塔古和他同事发现,在携带最常见APOE变体APOE3的人群中,CypA通道的激活和周细胞损伤可能与认知障碍无关。但是,在APOE3携带者中,是否血脑屏障的泄露是由与周细胞(例如,通过Aβ对内皮细胞的损伤)不相关的因素导致的,APOE携带者的认知功能障碍仍不明确。
在APOE2携带者中,血脑屏障的角色在当前研究中没有评估出来,还是不明确。尽管APOE2与其他APOE变异相比,阿尔茨海默症的风险减少了,这应该不大可能是由于更具弹性的血脑屏障所致,因为APOE2载体有很高的微出血风险,这表明血管脆弱。
血脑屏障是否以及如何导致认知障碍仍没有定论,是疾病过程导致的还是结果导致的?来自小鼠的证据表明,血液中的一些蛋白质,例如纤维蛋白,破坏了神经元间的突触联系。但这些蛋白质在人脑中的致病作用还没有得到证实。
不谈这些问题,蒙塔古等人拓展了对APOE4如何促进认知障碍的理解,他们也表示,不同的APOE状态能够通过不同的机制促进疾病。更深层次的理解基因变异导致阿尔茨海默症可能被证明是治疗这一普遍且无法治愈的疾病的更个人化方法的关键。
(转化医学网360zhyx.com)
参考:
【1】https://www.nature.com/articles/d41586-020-01152-8
【2】https://www.nature.com/articles/s41586-020-2247-3
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发