【Nature子刊】沉默SOD1基因,让渐冻人自由得更久一点!
| 导读 | 渐冻症,又名肌侧索硬化症(amyotrophiclateralsclerosis,ALS),尽管是发病率仅为十万分之三的罕见病,但在病程发展过程中,患者自由的思想将至死被逐渐禁锢在一个退化的躯壳中,造成极大的痛苦和社会经济负担,因此学界始终热切地寻找ALS的解药。 |

渐冻症,又名肌侧索硬化症(amyotrophic lateral sclerosis , ALS),尽管是发病率仅为十万分之三的罕见病,但在病程发展过程中,患者自由的思想将至死被逐渐禁锢在一个退化的躯壳中,造成极大的痛苦和社会经济负担,因此学界始终热切地寻找ALS的解药。
加州大学圣地亚哥分校的Marsala课题组近日在《Nature Medicine》上发表工作,对ALS模型小鼠、猪和非人灵长类动物软脊膜下注射以AAV9病毒为载体的shRNA,沉默超氧歧化酶SOD1基因,能有效防止运动神经元丢失或延缓疾病进程,显著延长ALS的生存时间!

ALS是一种致死性的进行性神经退行性疾病,即患者将遭受脑干和脊髓运动神经元的不可逆丢失,进而肌肉麻痹而无法行走、说话乃至吞咽,最终因呼吸衰竭或心跳暂停而死亡。ALS通常在中年50岁左右发病,男女发病比列为1.5:1,一旦确诊,平均生存期仅为2-5年,50%以上的患者在症状出现后30个月内去世。
历史上,ALS最先由法国神经生物学家Jean-Martin Charcot发现,因此又名夏科病;1930年代,美国著传奇棒球运动员扬基“铁马”Lou Gehrig因此骇人的疾病被迫挥别赛场后,ALS以“卢伽雷氏病”之名震惊全球;
伟大的物理学家、黑洞理论的提出者霍金在21岁罹患此病,与其抗争50多年之后,于2018年3月14日去世,这颗巨星的陨落令多少向往太空的少年痛失他们的织梦人。

斯蒂芬·霍金,已知存活最久的渐冻症战士
在走向死亡的单行道上,渐冻人注定无法停下命运的推搡。在和煦春日的草地上散散步,握握儿女温暖的小手,在爱人的凝视里做一个调皮的wink,这些朴素的日常竟都成了他们的奢望。
无力回春,江河日下,最后的他们甚至没有力气睁开眼睛,甚至不能发出一声无奈的叹息。当身体成为了一套逐渐收紧的枷锁,自由的思想还要在随时切断的供给中孤独地死去。ALS患者承受的不幸,亟需医药研究给出解答和解药。
然而,ALS发病的原因至今是个谜,学者们提出的猜想不一而足,认为多种途径共同参与了病理过程,包括谷氨酸兴奋性毒性、氧化应激、线粒体异常、神经炎症等退行性疾病的共享机制。
20多年前,超氧歧化酶SOD1被证实与一部分ALS发病相关。最近,广泛的证据显示ALS-SOD1突变基因在脊髓运动神经元和中间神经元表达异常标志物,因此成为潜在的临床靶标。
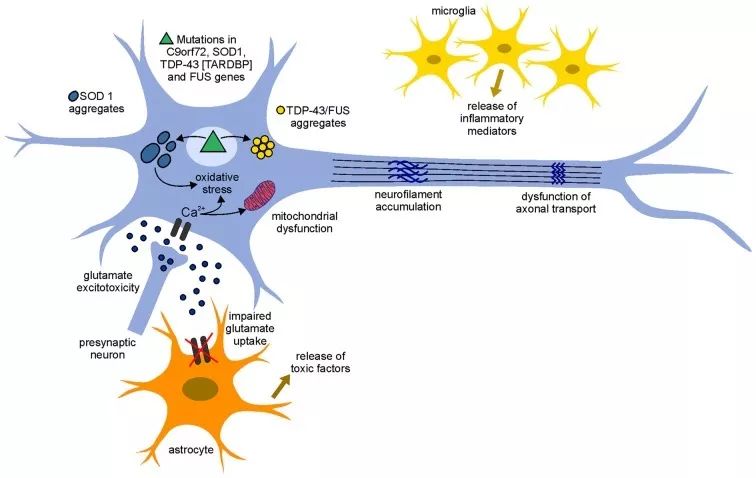
ALS的病理机制
Marsala课题组首先构建了负载特定shRNA的AAV9病毒工具,以整合并沉默SOD1基因。在SOD1蛋白错误折叠的SOD1G37R转基因模型小鼠的脊髓颈椎和腰椎两点进行软膜下(SP)注射,在ALS的症状出现前进行这项干预,能长期有效阻止运动神经元丢失和运动功能的退化,并且小鼠在整个实验过程中均存活;而对照组小鼠运动神经元产生60%以上丢失,并且很快死亡。
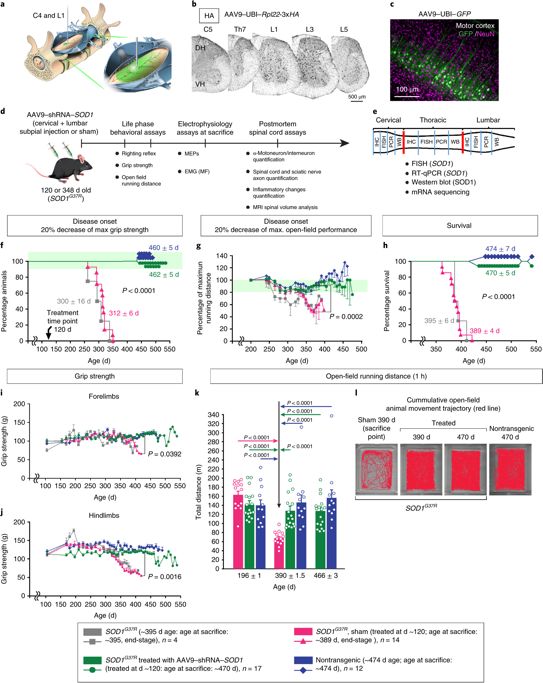
脊软膜下注射AAV9–shRNA–SOD1阻止疾病发生,并长时程有效保护运动功能
接着,研究者验证作此干预后,中枢运动神经元数量不仅没有显著减少,其功能也是正常的。在小鼠腓肠肌记录到的神经肌接头放电正常,而非异常的高幅度波形;组织切片发现,实验组小鼠肌肉亦不发生去神经化,说明没有ALS的症状。
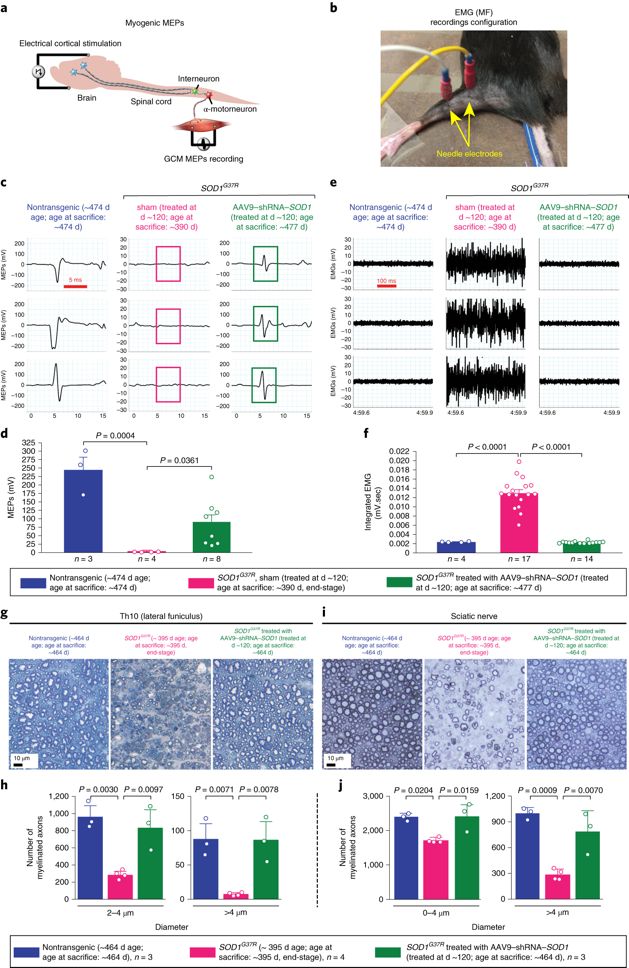
AAV9–shRNA–SOD1维持肌电正常并防止去神经化
同时,研究者通过qPCR和免疫组化,验证AAV9包载的shRNA能够沉默脊髓运动神经元的SOD1基因,减少了SOD1蛋白的错误折叠,说明该病毒工具的作用靶点确实与设想相同。
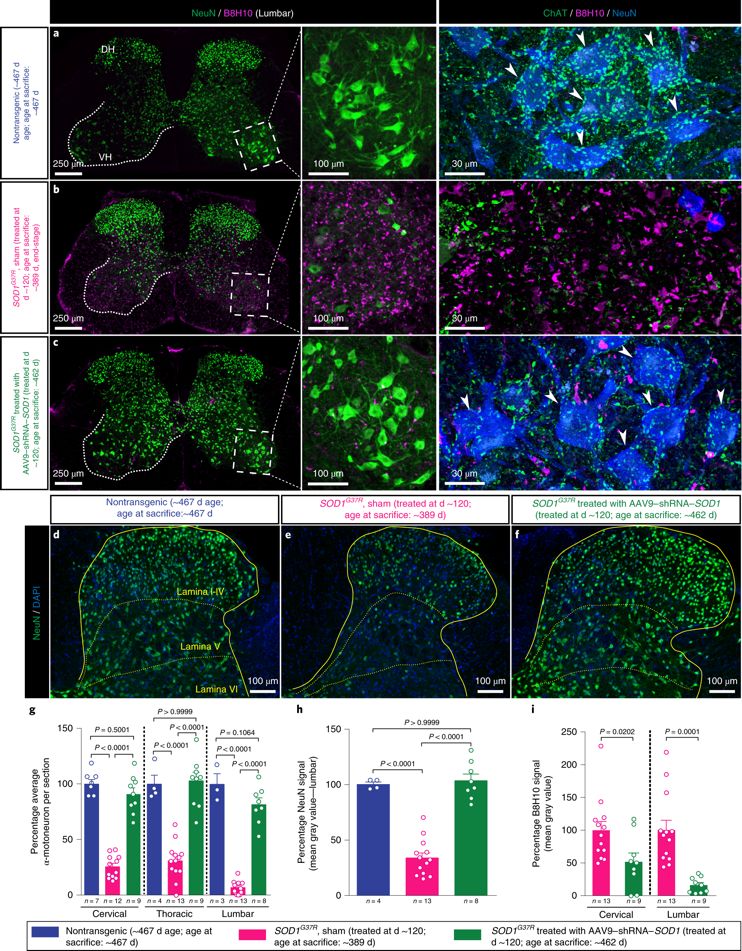
AAV9–shRNA–SOD1减少SOD1基因错误折叠,将疾病扼杀在摇篮中
最后,为了探索这种基因治疗策略的临床应用可能性,研究者们在与人体更相近的猪和非人灵长类上注射验证性的工具病毒,发现AAV9能将包载内容有效递送并表达在脊髓运动神经元和脑干运动中枢,并发现脊软膜下注射,而非鞘内注射,能够使其发挥作用。
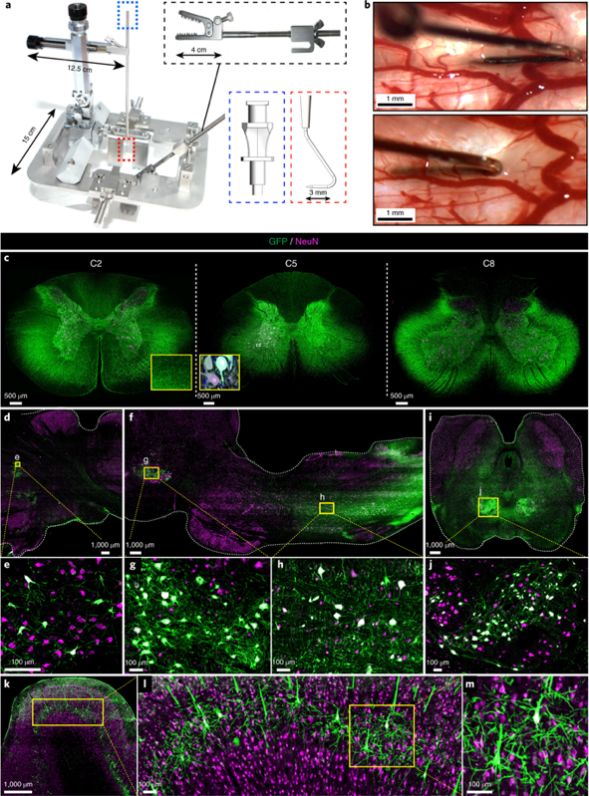
AAV9在猪脊髓运动神经元和脑干的有效递送
由于ALS是一种不可逆转的神经系统疾病,早期症状包括大拇指僵硬无力、肌肉跳动、无力、走路不稳、说话含糊等,一般尽早发现相关迹象并就医,才可能有更大的挽救空间,而本文中研究者发现,在ALS发生一段时间后给予AAV9基因治疗,也能阻止疾病恶化,说明这种治疗策略在发病前和发病时用药均有效。
目前,ALS的药物市场依然青涩。赛诺菲公司的ALS孤儿药、一线药物利鲁唑(riruzole)为谷氨酸受体拮抗剂,能够减少神经的谷氨酸毒性。利鲁唑是第一个能够延长ALS患者存活时间的药物,也是唯一通过美国FDA批准的药物,一经问世便引起轰动。然而,它只作用于神经退行性疾病的一般特征,确切的作用原理尚不明确,且副作用较严重,每月用药成本极高,千金难求。
利鲁唑(力如太,riruzole)
Bravo-Hernandez等提出的软脊膜下注射AAV9-shRNA-SOD1点基因治疗策略,在某些ALS发病前施用,能显著延长存活时间、大幅度保留运动神经元功能和运动能力;甚至在疾病发生后施用,也能阻止病程进展。该策略展现出清晰的作用机制,提示了其重大的临床应用价值,有望打破ALS孤儿药的艰难局面!
参考文献:
Bravo-Hernandez M, et al. Spinal subpial delivery of AAV9 enables widespread gene silencing and blocks motoneuron degeneration in ALS. Nature Medicine, 23 Dec, 2019.
ALS Pathogenesis and Therapeutic Approaches: The Role of Mesenchymal Stem Cells and Extracellular Vesicles. Frontier Cell Neuroscience, 2017.
推荐阅读:
-
Nature:为何女性免疫力更强?清华学者来揭秘!
-
重磅:I型糖尿病的免疫新靶点“诞生”!
-
聚焦:免疫治疗总是无功而返?这口锅或许该扔给中性粒细胞
-
拜拜夜宵!Cell子刊证实限时饮食可显著改善代谢综合征患者健康指标
-
Science子刊背靠背:阿尔茨海默症浮现新的诊断指标!
- 实锤了!减肥持续有效逆转2型糖尿病症状
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发