《Nature》子刊:揭秘癌症免疫治疗患者反应巨大差异关键原因,有望覆盖所有患者!
| 导读 | 癌症免疫治疗的问世曾一度扭转了之前癌症治疗的僵局,获得了众多科学家的认可。然而,随着癌症免疫治疗的推广,越来越多的弊端日渐显露出来,就拿CAR-T疗法来说,肿瘤细胞靶点并未完全突破。 |
作者:Paris
导 语:癌症免疫治疗的问世曾一度扭转了之前癌症治疗的僵局,获得了众多科学家的认可。然而,随着癌症免疫治疗的推广,越来越多的弊端日渐显露出来,就拿CAR-T疗法来说,肿瘤细胞靶点并未完全突破。目前还未完全掌握所有癌细胞的表面特异性抗原蛋白,也就是我们所说的靶点。如果想要未来使用CAR-T治疗更多种类的癌症,我们必须不断地发现新靶点。其次,CAR-T细胞或多或少还是会存在一些风险,例如细胞因子风暴以及神经毒性等。最后,也是目前癌症免疫治疗最需要突破的一点:各癌症患者之间存在极大的治疗反应差异。
近日,墨尔本伦敦大学学院和彼得·麦克卡伦癌症中心的科学家们在这一领域终于取得了突破:他们发现,白细胞释放出有毒的蛋白质来杀死癌细胞和病毒感染细胞,不同于化疗的杀敌一千自损八百,它们利用自身细胞包膜的物理特性来保护自己免受任何伤害。这极大程度上解释了癌症患者对癌症免疫疗法的反应差异,相关文章已在线发表在《Nature communications》上。

癌症免疫细胞治疗,是从我们的身体中把与癌细胞和病毒等异物战斗的免疫细胞从患者血液中取出,在实验室培养增加数量,回输到体内,再次恢复患者免疫的力量,攻击肿瘤的治疗方法。
癌症发生之后,人体主要是通过第三道防线进行对抗,发挥作用的是各类免疫细胞。而细胞毒性T淋巴细胞(CTL细胞)则是T细胞中的主力军,杀起癌细胞来干脆利落。这一类细胞都带着CD3+CD8+的分子标记,它们可以直接攻击被病原体“附身”的细胞或者发生变异的癌细胞,在查看过细胞身份证“MHC蛋白”后就会毫不犹豫的分泌“穿孔素”和“颗粒酶”,能够直接穿过细胞的身体(细胞膜),使细胞全身溶解而死。
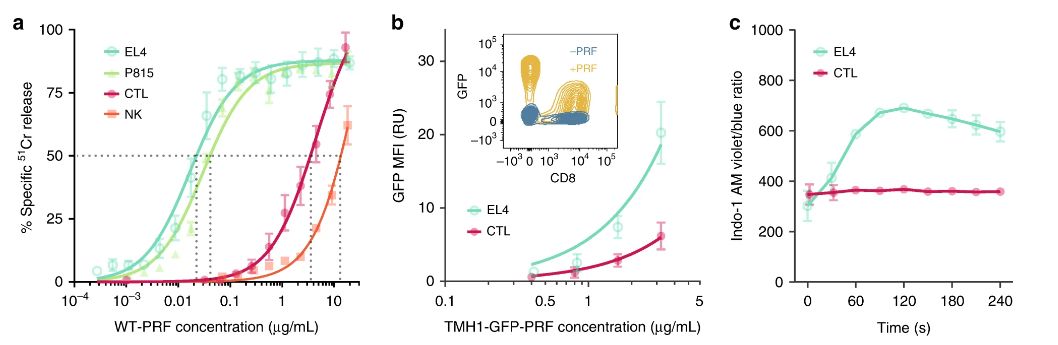
CTL结合较少的穿孔素并形成抗性
虽然CTL和靶细胞都暴露在突触内的穿孔素中,但只有靶细胞膜被破坏,而CTL无一例外地逃脱了。这极大程度上引起了该研究团队的兴趣。为何穿孔素会有选择性地进行破坏呢?这会是还谜题的突破点吗?为此,科学家们对穿孔素进行了研究。
穿孔素是负责打孔的蛋白质。他们发现穿孔素对细胞表面的粘附强烈地依赖于 molecules—so-called 包围和保护白血球的膜中的脂质。在最初,分泌的穿孔素通过钙依赖性膜结合与靶细胞相互作用,通过其C2结构域介导。其次是低聚成短和非插入式预孔组件,并最终通过插入和进一步组装整个成熟孔跨质膜。越来越多有序和更紧密的脂质分子堆积导致穿孔素结合减少,并且当人为地破坏白细胞中这种脂质的顺序时,细胞对穿孔素便变得更加敏感。当白细胞暴露在如此多的穿孔素中,结合穿孔素仍然不能杀死白细胞,这表明必须有另一层保护。进一步探索发现,这是因为一些脂质分子的负电荷被运送到细胞表面,与剩馀的穿孔素结合,阻止它破坏细胞膜。
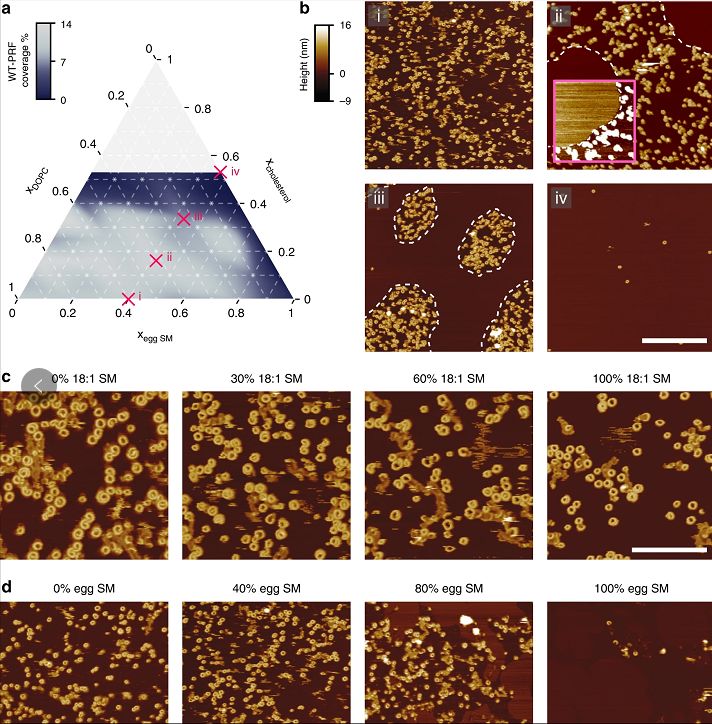
脂质顺序可保护膜免受穿孔素的形成
其实,现有研究已经提示了我们,局部脂质顺序可以改变细胞之间的交流方式。但令人惊讶的是,精确的物理膜特性也可以提供如此重要的保护层来抵御分子打孔机(穿孔素)。
在本次研究中,研究人员了解到CTLs通过在突触内质膜的两种保护特性来实现这一点:CTL膜排斥穿孔素通过将其脂类在免疫突触中的有序状态(脂筏),同时也暴露在突触内的磷脂酰丝氨酸(PS),从而产生负电荷的汇,隔离并使任何残留的穿孔素失活。细胞对穿孔素的抗性支持了它们杀死多个目标的能力,并使它们能够维持免疫平衡从而进行自我保护。总之,CTL通过动态控制其膜脂组成来保护自己免受穿孔素的侵害。
该研究为癌症免疫治疗的优化提供了理论基础,有望再次打破目前癌症治疗的僵局,让我们拭目以待。
参考文献
Jesse A. Rudd-Schmidt, Adrian W. Hodel, Lipid order and charge protect killer T cells from accidental death
https://www.nature.com/articles/s41467-019-13385-x
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发