《Cell》子刊:华人科学家叫板CTLA-4免疫检查点阻断假说
| 导读 | 近几年来,针对CTLA-4、PD-1和PD-L1的单抗药物在免疫治疗中的效果逐渐获得认可,癌症免疫治疗中的免疫检查点 (Immune Checkpoint)概念也越来越深入人心。2018年2月22日,著名期刊Cell Research在线发表了来自美国马里兰大学医学院刘阳/郑盼教授联合实验室的最新研究成果。 |
近几年来,针对CTLA-4、PD-1和PD-L1的单抗药物在免疫治疗中的效果逐渐获得认可,癌症免疫治疗中的免疫检查点 (Immune Checkpoint)概念也越来越深入人心。2018年2月22日,著名期刊Cell Research在线发表了来自美国马里兰大学医学院刘阳/郑盼教授联合实验室的最新研究成果。

研究表明,长久以来流行的抗CTLA-4抗体Ipilimumab在癌症免疫治疗中的免疫检查点假说
并不成立。
即Ipilimumab并没有通过阻断CTLA-4/B7相互作用而发挥抗肿瘤效果,而清除肿瘤局部高表达CTLA-4的调节性T细胞(Treg)在有效的免疫治疗中至关重要。此项研究成果有助于研发新一代高效的抗CTLA-4抗体以及其它以CTLA-4为靶点的抗癌药物。
CTLA-4分子高表达于调节性T淋巴细胞(Treg)和激活的T淋巴细胞上。正常情况下,T淋巴细胞的活化需要两条信号通路共同激活(图1),其一是T细胞受体(TCR)与抗原呈递细胞(APC)呈递的MHC-抗原肽复合物相结合(信号1),其二是B7分子(B7-1或B7-2)与T细胞表面的共刺激分子CD28相结合(信号2)。
T细胞活化后高表达的CTLA-4分子虽然与CD28具有高度同源性,但功能相反,即CTLA-4分子与B7分子结合后抑制T细胞的活化。
2011年,美国FDA批准首款抗CTLA-4抗体抑制剂Ipilimumab(商品名YERVOY®)用于黑色素瘤的治疗,其疗效显著。根据免疫检查点阻断的假说(Checkpoint Blockade Hypothesis),在外周淋巴器官,抗CTLA-4抗体如Ipilimumab是主要通过阻断抑制性的CTLA-4/B7信号通路(图1),从而促进T细胞的激活而发挥抗肿瘤作用。然而这一流行的关于Ipilimumab在癌症免疫治疗中发挥作用的主要假说并没有得到严格的实验验证。
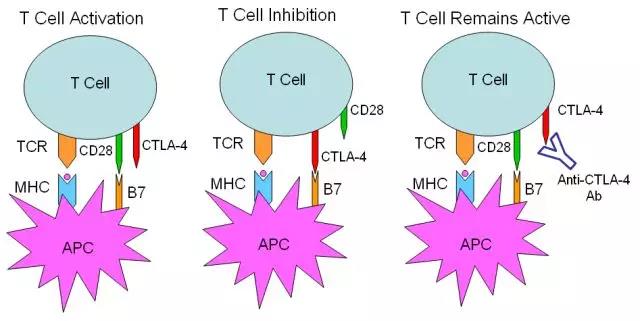
图1. T细胞的活化需要通过TCR/MHC(信号1)和CD28/B7(信号2)进行共刺激。 抗原呈递细胞(APC)上的B7分子与T细胞上的CTLA-4的结合抑制T细胞功能。 抗CTLA-4抗体阻断CTLA-4结合B7并阻止其对T细胞功能的抑制。
虽然Ipilimumab可以阻断锚定状态的CTLA-4分子和游离的B7分子的相互作用 (图2A),但B7分子是膜表面表达的共刺激分子,因此以前的研究并不能证实Ipilimumab能够有效阻断在生理状态下的CTLA-4和B7的相互作用。刘阳/郑盼教授联合实验室的研究表明,当B7分子被固定后(比如B7包被在ELISA板上时[图2B]或者表达在细胞表面时[图2C]),Ipilimumab在体外并不能很好地阻断细胞表面的CTLA-4/B7的相互作用(图2D),也不能有效地阻断CTLA-4介导的B7分子的转胞吞(Transendocytosis)作用(图2E)。
与此不同的是,刘阳/郑盼教授联合实验室筛选出的另外一种抗CTLA-4的抗体L3D10,却能非常显著地阻断各种形式的CTLA-4/B7的体外相互作用(图2)。 此外,在human CTLA-4 knock-in的人源化小鼠和human CD34+ stem cells重组的NSG小鼠中,L3D10而不是Ipilimumab,能够显著抑制human CTLA-4对脾脏树突状细胞表面B7分子的转胞吞下调(图2F),从而提供了在体内实验中的生理状态下Ipilimumab不能有效阻断CTLA-4/B7相互作用的证据。

图2. 当B7分子被固定时,L3D10而不是Ipilimumab,能够在体外和体内显著阻断CTLA-4/B7的相互作用。
更重要的是,刘阳/郑盼教授联合实验室的研究指出,阻断CTLA-4/B7的相互作用,并没有贡献于抗CTLA-4抗体的抗肿瘤效果。这一论断来自多个方面的实验证据:
(1)
在human CTLA-4全人源化(CTLA4h/h,即CTLA4的两个等位基因均来自human)的小鼠模型中,抗human CTLA-4的抗体L3D10能够有效阻断CTLA-4/B7的相互作用;而在human CTLA-4半人源化(CTLA4h/m,即CTLA4的两个等位基因一个来自human,一个来自mouse)的小鼠模型中,只能识别human CTLA-4的L3D10不能有效阻断CTLA-4/B7的相互作用。尽管如此,在CTLA-4全人源化和半人源化的小鼠模型中,L3D10和Ipilimumab都能有效的消除MC38肿瘤(图3A和图3B)和减缓B16肿瘤的生长。
(2)
将半人源化的L3D10进行完全人源化后筛选得到的两株失去阻断CTLA-4/B7相互作用能力的HL12和HL32抗体(图3C),并没有影响其抗肿瘤的作用,因为HL12和HL32展现出与Ipilimumab一样的抗肿瘤效果(图3D)。
(3)
用B7分子的阻断性抗体1G10/GL1处理实验小鼠,在事先阻断B7功能的情况下,Ipilimumab仍能发挥有效的抗肿瘤作用,进一步说明其并不依赖于阻断抑制性的CTLA-4/B7信号通路(图3E)。
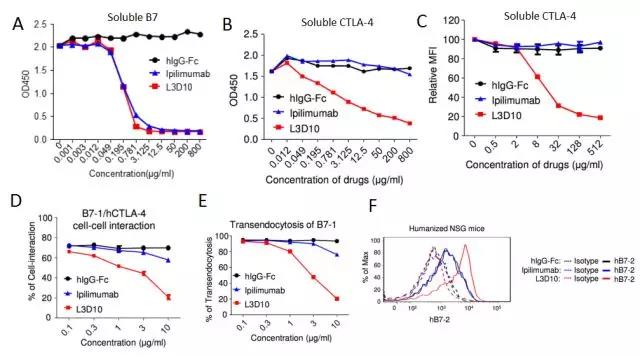
图3. 抗CTLA-4抗体治疗肿瘤的主要分子机制是通过清除肿瘤局部的Treg,而不是通过阻断CTLA-4/B7相互作用的抑制性信号通路。
深入研究表明,所有能有效抗肿瘤的抗CTLA-4抗体,包括强阻断能力的L3D10和非常弱阻断能力的Ipilimumab/HL12/HL32,都能够有效的清除肿瘤局部的Treg(图3F和图3G)。而用Fc受体的阻断抗体2.4G2同时处理小鼠来消除抗体介导的细胞杀伤作用和抗体介导的细胞吞噬作用,则能显著逆转Ipilimumab的抗肿瘤效果(图3H)。
因此,刘阳/郑盼教授联合实验室的研究表明,抗CTLA-4抗体发挥治疗肿瘤功效的主要分子机制是通过清除肿瘤局部的Treg,而不是通过阻断CTLA-4/B7相互作用的抑制性信号通路。这项研究有力地驳斥了当前流行的在癌症免疫治疗中针对CTLA-4分子的免疫检查点的理论假说。
本研究完成于作者先前所在的美国国立儿童医学中心的癌症与免疫学研究中心。作为论文的共同第一作者,杜雪相博士和唐飞博士在刘阳教授和郑盼教授的共同指导下完成了此课题的主要内容,刘明月博士贡献了部分数据。美国OncoImmune, Inc公司、美国Immutics, Inc公司以及中国Alphamab, Inc公司提供了抗体等实验试剂和Biacore等技术支持。本研究得到来自美国国立卫生研究院和OncoImmune, Inc公司的基金资助。 (转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发