《Nature》揭秘:癌症之王的早期“迁徙”之路!
| 导读 | 突变景观与表型的相关性不足限制了我们对胰腺导管腺癌(PDAC)发病机制和转移的理解。最近,研究人员发现人类PDAC前体中突变型KRAS的基因剂量增加,这推动了早期的肿瘤发生和转移,从而使早期PDAC传播合理化。 |
像胰腺癌那样具有侵略性的恶性肿瘤的根源难以寻觅。尽管如此,慕尼黑科技大学(TUM)科学家已经揭示了胰腺癌早期发生的突变事件,并解释了它最终如何迅速成长和扩散。
由Roland Rad博士和Dieter Saur博士教授领导的TUM团队明确了胰腺癌沿各种突变路径所发生的特定基因扩增。基本上,某些基因不仅发生突变,而且被不断复制,进而推动胰腺导管腺癌(PDAC)的早期肿瘤发生和转移。
这项研究以“Evolutionary Routes and KRAS Dosage Define Pancreatic Cancer Phenotypes”为题发表于1月24日的《Nature》杂志上。

为了研究在细胞增殖中起关键作用的癌基因KRAS(其在90%的所有人类胰腺肿瘤中被激活),TUM科学家开发了“转移性PDAC小鼠的细胞培养”技术。
Saur教授解释说:“小鼠模型使我们能够在分子水平密切地观察和有效地检查癌症发展的复杂过程:从健康细胞到癌症前兆,直到侵袭性肿瘤,并传播到其他器官”。
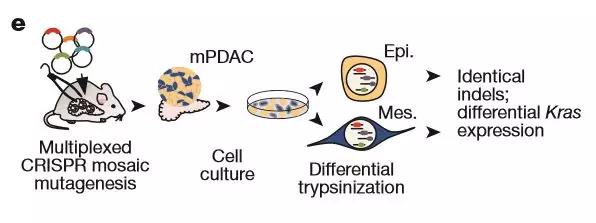
转移性PDAC小鼠的细胞培养
在诱导KRAS突变之后,研究人员还在所谓的肿瘤抑制基因中观察到其他突变。在健康的细胞中,这些保护性基因可防止癌症的发展。然而,当这些基因突变时,TUM研究人员发现,突变的KRAS基因或其他癌症基因可能会被扩增。哪些基因被扩增似乎取决于哪些肿瘤抑制基因受到影响,以及它们的功能受损的程度。
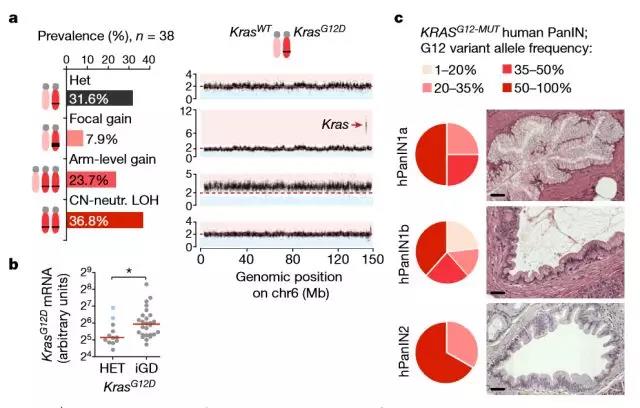
突变KRAS基因剂量增加在PDAC进化早期发生并驱动转移
研究人员通过功能研究和人类数据整合细胞培养基因组、转录组和肿瘤表型,揭示了致癌剂量变化对细胞形态的可塑性、组织病理学和临床结果的广泛影响,这些肿瘤细胞具有侵袭性未分化表型的最高KrasMUT水平。并且,他们还确定了杂合的KrasMUT可与其他致癌基因(Myc,Yap1或Nfkb2)协同驱动肿瘤发生,但其转移能力较低。
只有在细胞的内在保护机制被关闭并且剂量放大发生后,肿瘤才会最终形成。细胞跟随哪个途径、涉及哪些基因,在很大程度上决定了胰腺肿瘤的特征。
文章作者说:“从机制上讲,不同的致癌作用和剂量会沿着不同的进化路线进化,得到明确的等位基因状态和/或标志性肿瘤抑制因子改变(Cdkn2a,Trp53,Tgfβ通路)组合的允许。因此,突变上的限制和意外事件直接导致致癌剂量增加和沿着明确途径的变化,从而推动PDAC的早期发展并形成其下游生物学效应。剂量扩增模型第一次允许鉴定和解释肿瘤侵袭性和转移的遗传模式。”
该研究的主要作者SebastianMüller指出:“因此,由于存在额外的基因拷贝,细胞似乎放大了生长信号。这种肿瘤发展过程中的剂量放大模型在以前并没有被考虑过。研究还表明,随着突变KRAS拷贝数量的增加,肿瘤的侵袭性和转移能力也增加”。
“有迹象表明,我们的发现构成了肿瘤发展的一个基本原则,在其他癌症中发挥了重要作用,”Rad教授说,“我们现在正在研究癌症生物学的新见解并通过它们开发新的治疗策略”。(转化医学网360zhyx.com)
参考资料:
Evolutionary Routes and KRAS Dosage Define Pancreatic Cancer Phenotypes. doi:10.1038/nature25459
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发