突破性研究!中山大学孙逸仙纪念医院林天歆/陈长昊团队发现特殊的B细胞亚群,系统揭示其破坏三级淋巴结构抑制抗肿瘤免疫反应
| 导读 | 该研究首次揭示了B细胞在肿瘤微环境中的“阴暗面”,颠覆了以往认为B细胞主要发挥抗肿瘤作用的传统认知。 |
近日,中山大学孙逸仙纪念医院林天歆/陈长昊团队在国际知名期刊期刊《Cancer Cell》发表一项突破性研究:通过单细胞RNA测序和空间转录组分析,研究团队在膀胱癌中发现了一个特殊的B细胞亚群——IGLL5+ B细胞。这类细胞会直接破坏三级淋巴结构(TLSs)的完整性,从而抑制抗肿瘤免疫反应。该研究首次揭示了B细胞在肿瘤微环境中的“阴暗面”,颠覆了以往认为B细胞主要发挥抗肿瘤作用的传统认知。
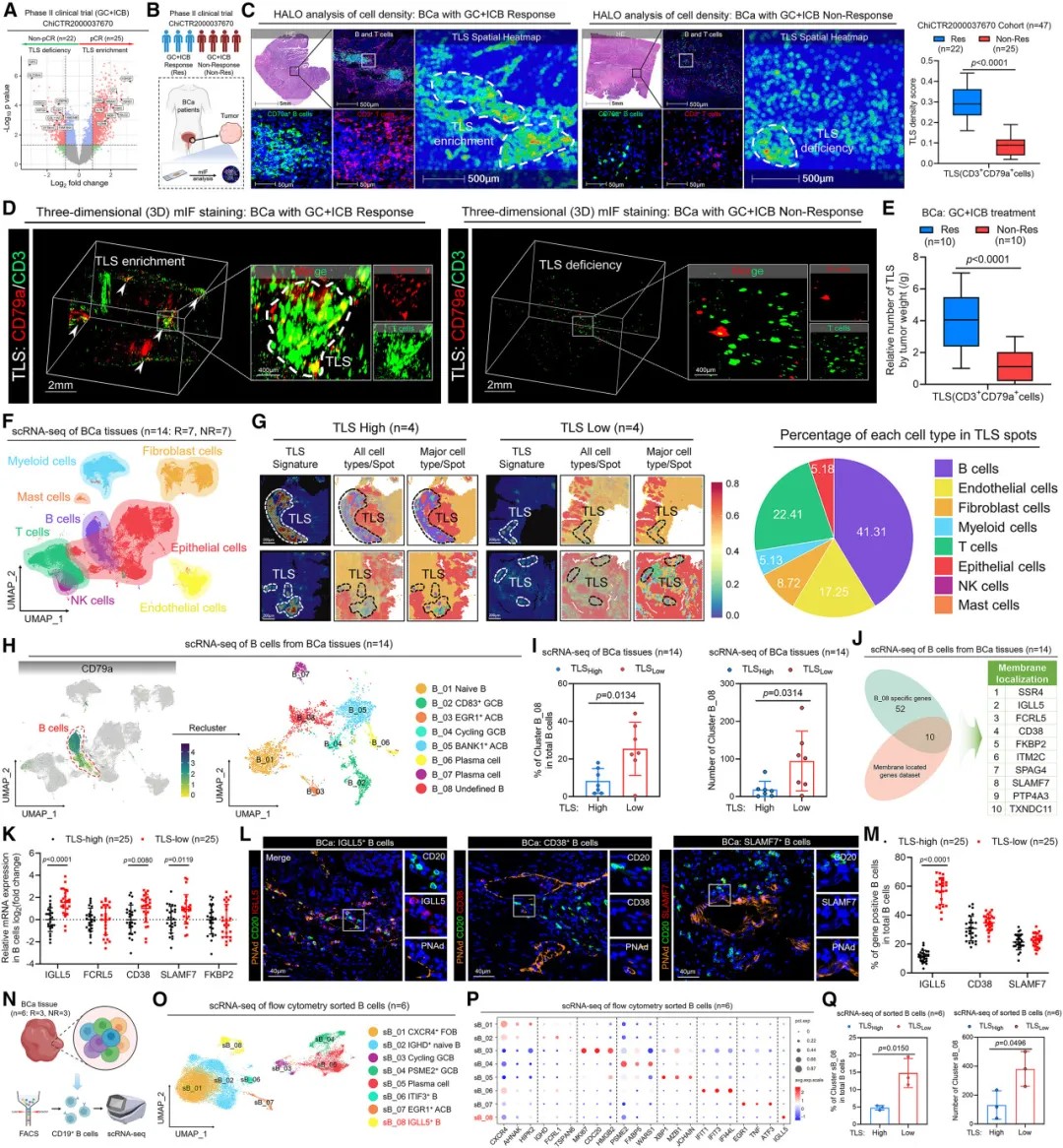
IGLL5+ B细胞富集于三级淋巴结构缺陷的肿瘤中
核心发现:IGLL5+ B细胞的发现与特征
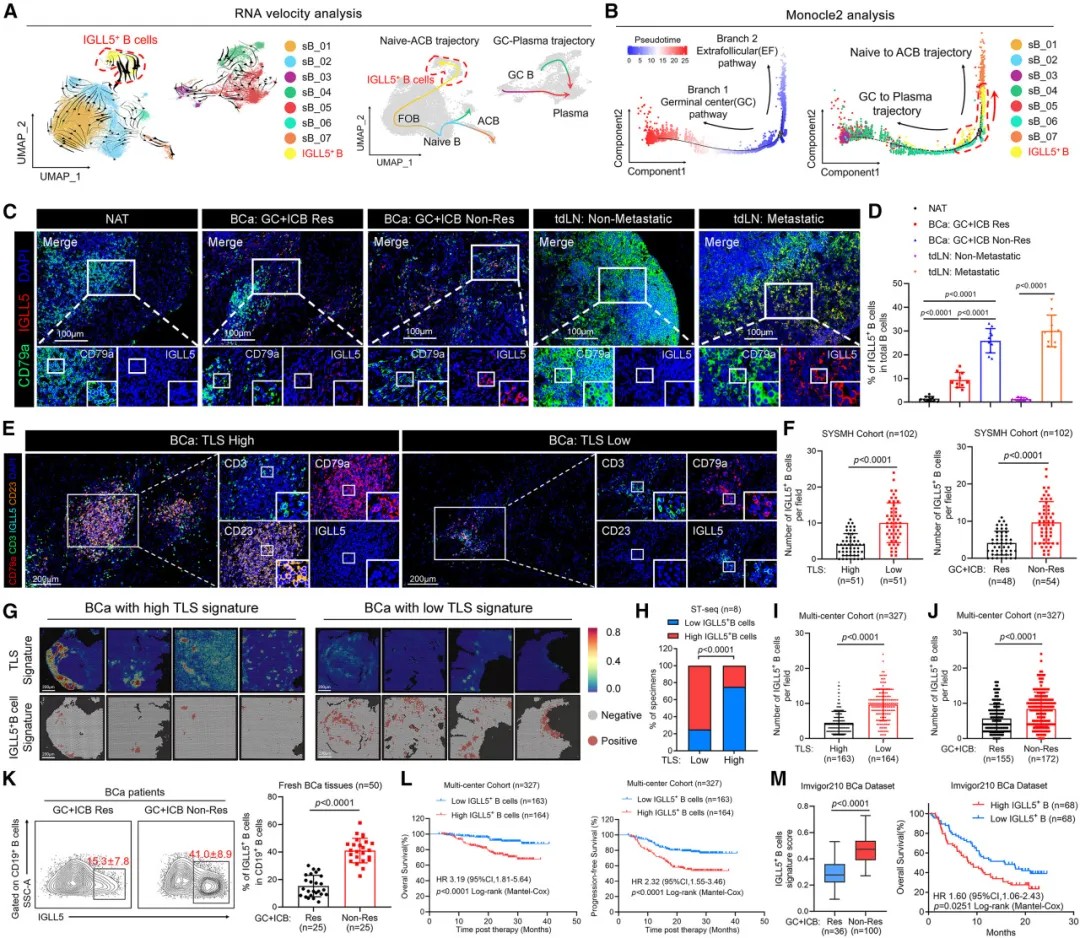
IGLL5+ B细胞与三级淋巴结构丰度及患者预后呈负相关
研究团队通过对膀胱癌患者样本进行单细胞RNA测序,在B细胞中识别出8个不同的亚群。其中一个特殊亚群高表达IGLL5基因,被命名为IGLL5+ B细胞。
与典型的B细胞不同,IGLL5+ B细胞表现出明显的免疫抑制特性。它们主要分布于TLSs缺陷的肿瘤区域,且与免疫治疗无应答密切相关。在多中心临床队列中,IGLL5+ B细胞的高浸润与患者总生存期和无进展生存期缩短显著相关。
进一步分析显示,IGLL5+ B细胞的抗体产生能力显著降低,B细胞受体多样性也较为有限,表明其免疫功能存在缺陷。这类细胞在肿瘤微环境中大量积聚,可能通过某种机制干扰正常的抗肿瘤免疫应答。
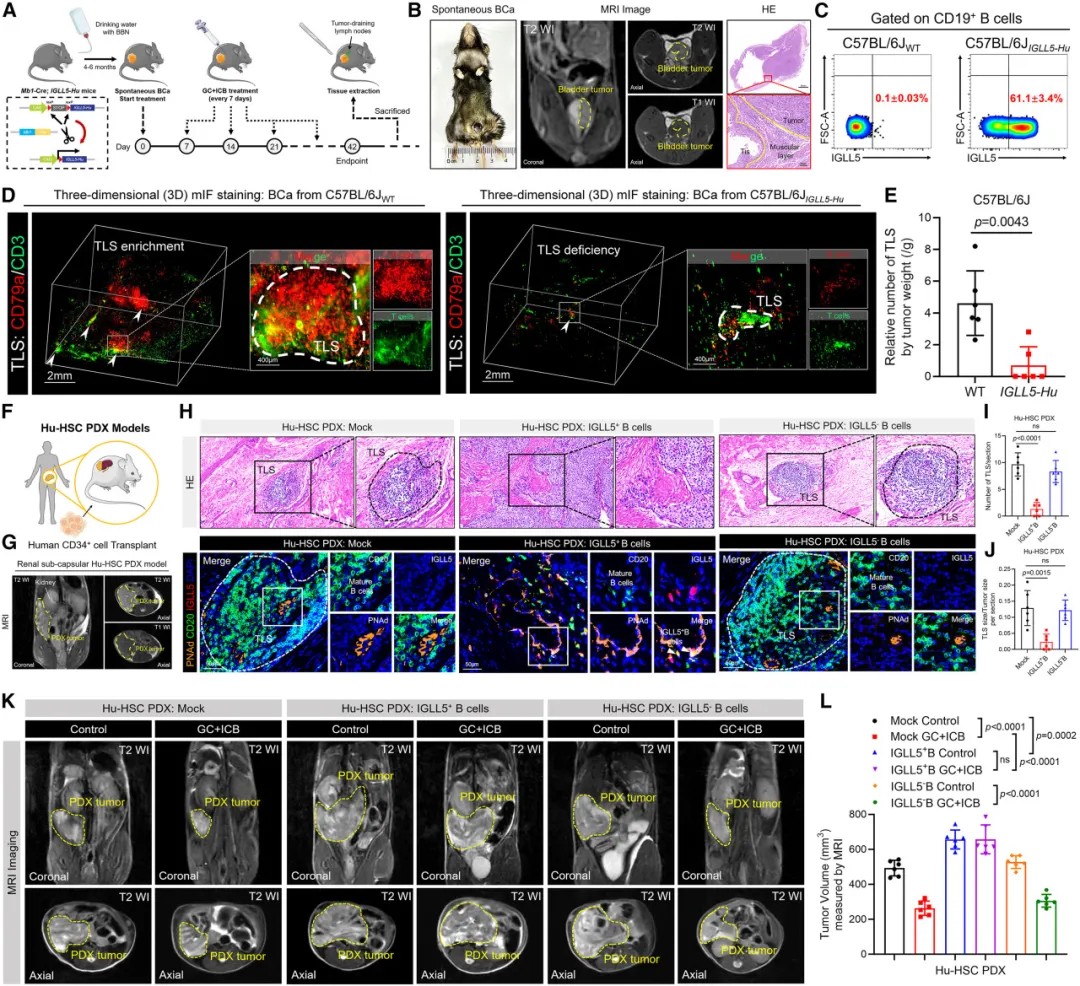
IGLL5+ B细胞破坏三级淋巴结构稳态并削弱人源化小鼠对免疫检查点阻断疗法的应答
分子机制:IGLL5如何破坏淋巴结构
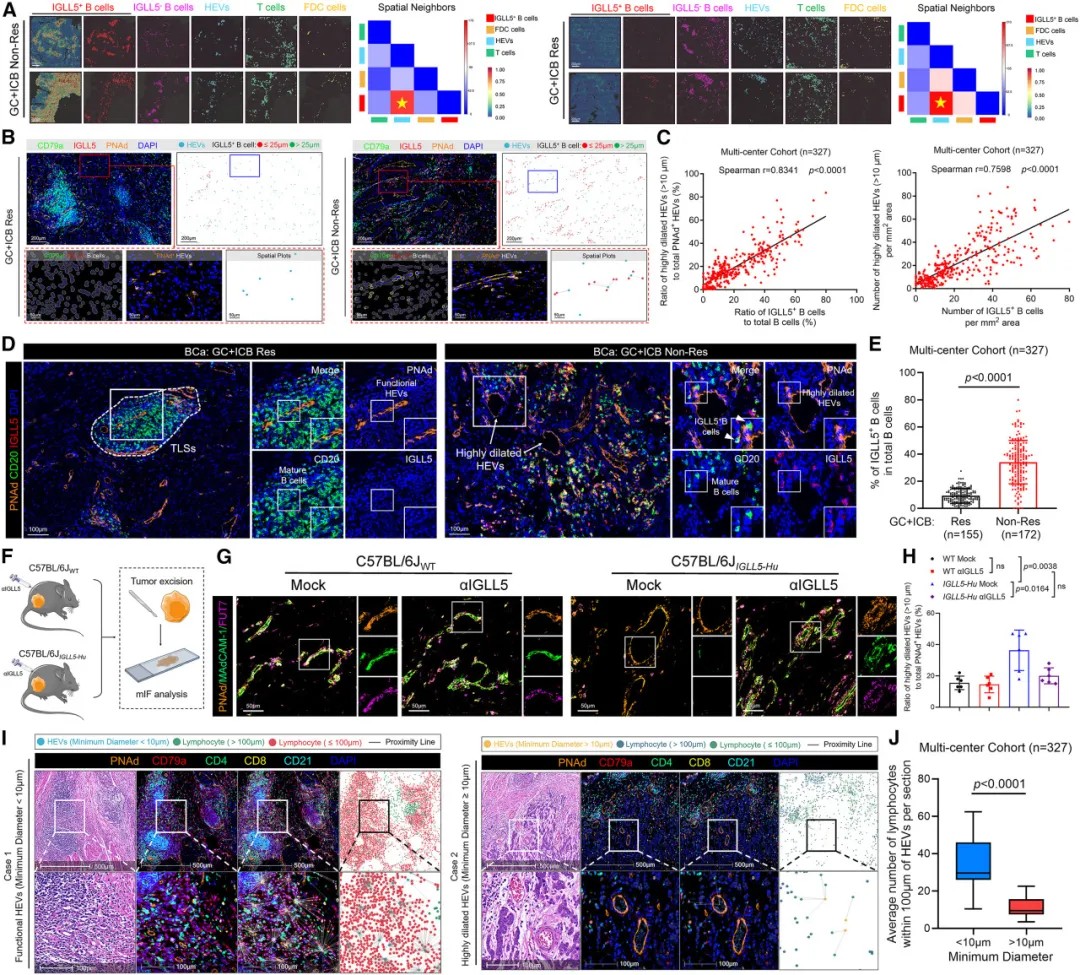
IGLL5+ B细胞锚定在高内皮微静脉上以损害其功能表型
研究团队发现,IGLL5+ B细胞通过与高内皮小静脉的相互作用破坏TLSs的稳定性。高内皮小静脉是淋巴细胞从血液进入淋巴组织的主要通道,对维持TLSs结构至关重要。
机制研究表明,IGLL5直接与高内皮小静脉表面的LTβR受体结合,触发该受体构象变化,抑制非经典NF-κB信号通路。这一信号通路对高内皮小静脉的功能维持至关重要,其抑制导致高内皮小静脉管腔扩张,功能丧失。
尤为重要的是,IGLL5与LTβR的结合亲和力极高,形成了类似“锁钥”的分子相互作用。这种特异性结合阻断了正常激活信号,最终导致TLSs结构解体和功能丧失。
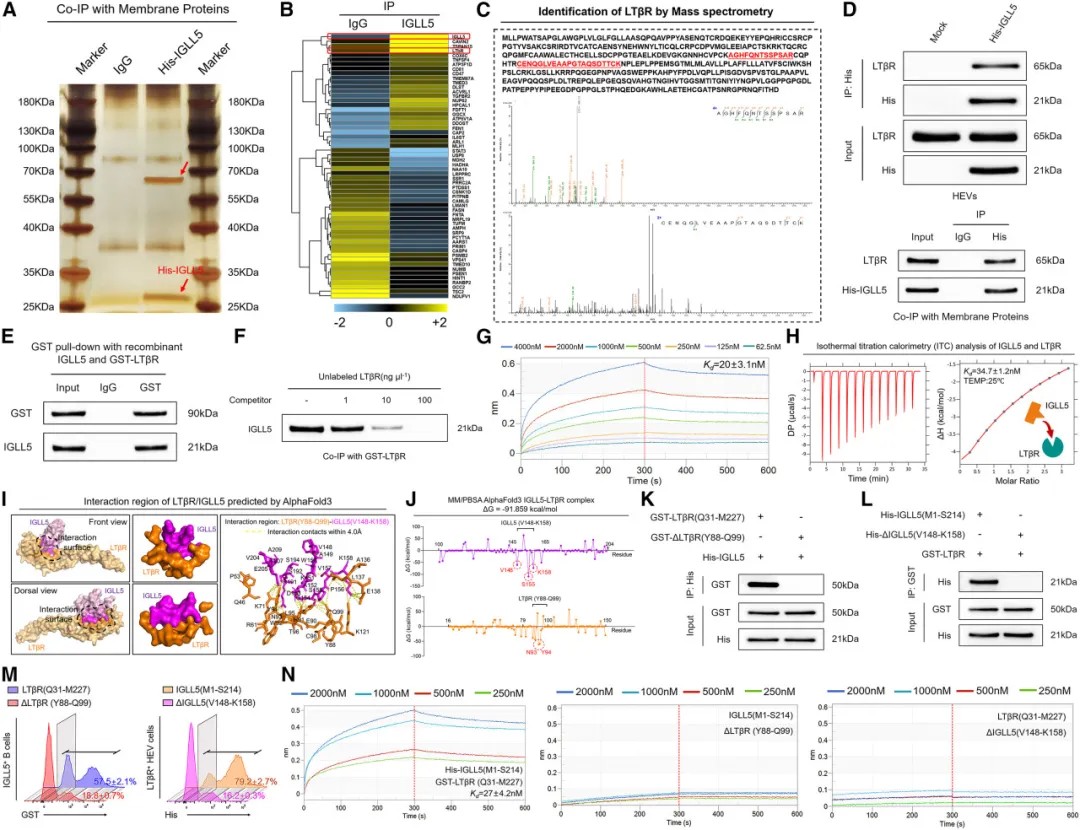
IGLL5与高内皮微静脉上的受体LTβR结合
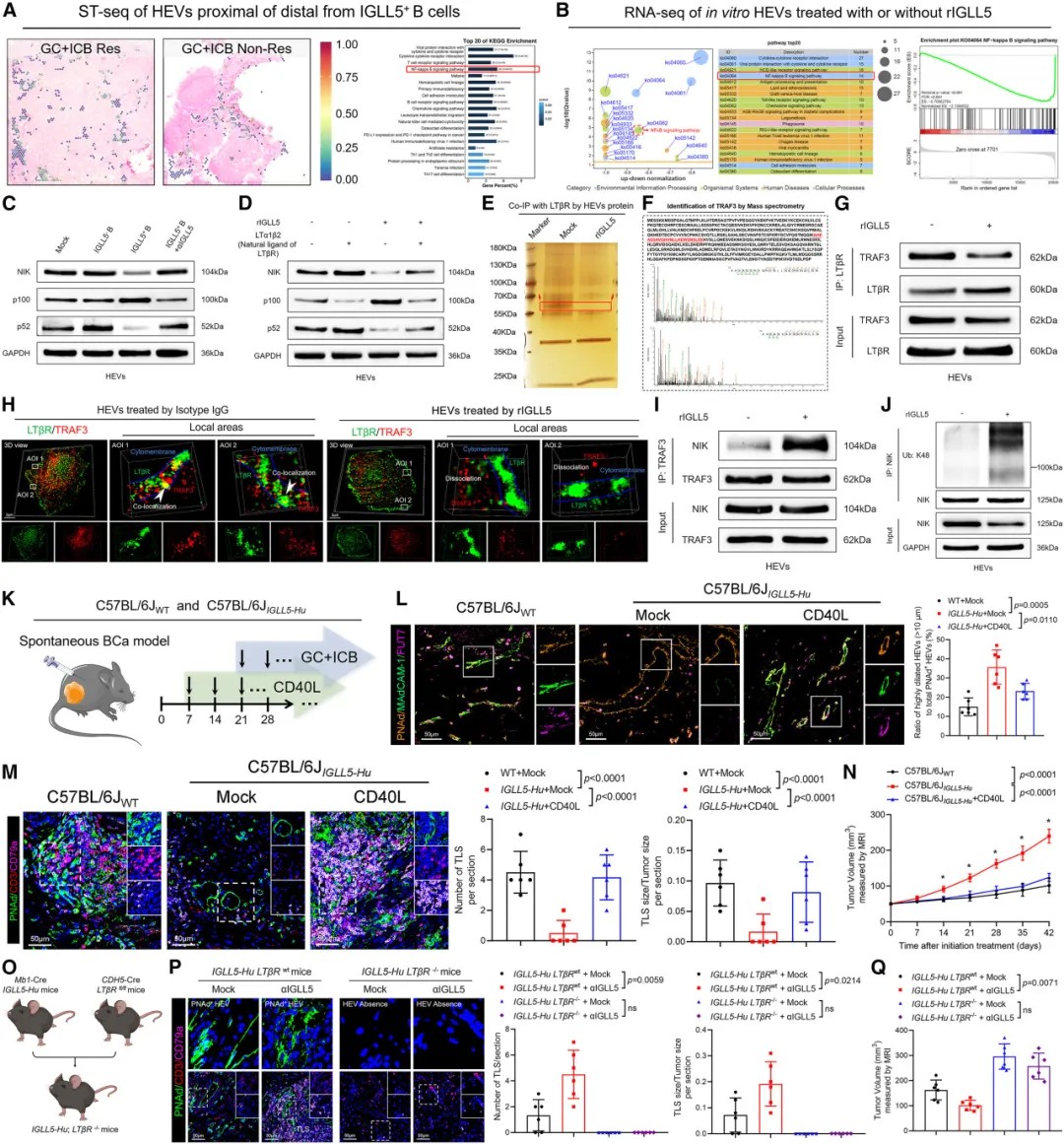
IGLL5-LTβR相互作用抑制NIK/p100/p52信号通路以阻碍三级淋巴结构形成
实验验证:从基因工程鼠到人源化模型
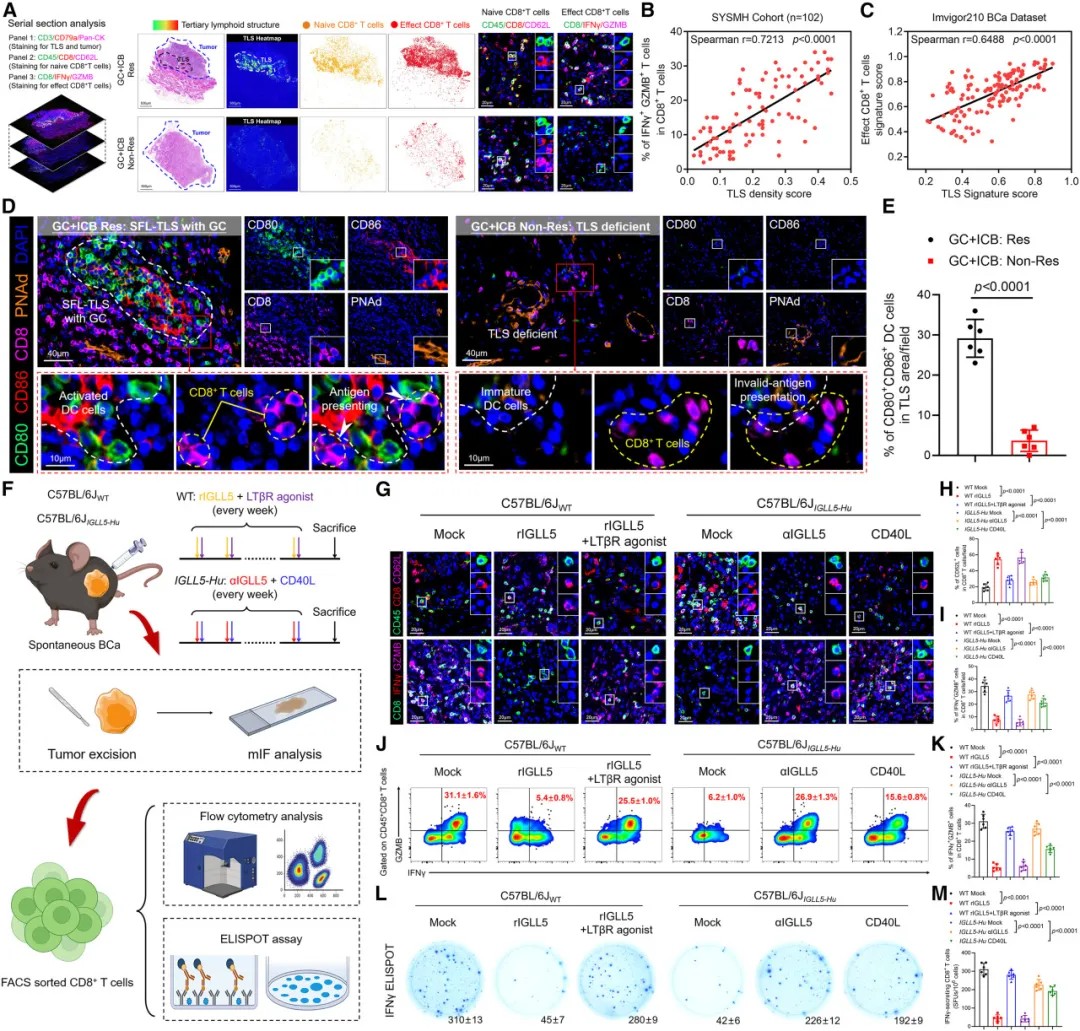
三级淋巴结构缺陷抑制CD8+ T细胞的活化
为验证IGLL5+ B细胞的功能,研究团队构建了IGLL5人源化基因工程小鼠模型。这些小鼠在暴露于致癌物质后发展出自发性膀胱癌,且其肿瘤微环境中IGLL5+ B细胞大量浸润。
与野生型小鼠相比,人源化IGLL5小鼠几乎完全缺失肿瘤内TLSs,且对免疫检查点抑制剂治疗不敏感。而当使用rCXCL13等TLSs诱导因子后,这一抑制效应被逆转。
在人源化造血干细胞移植模型中,注射IGLL5+ B细胞显著破坏了已建立的TLSs结构,而对照组的TLSs保持完整。这一发现直接证实了IGLL5+ B细胞对TLSs的破坏作用。
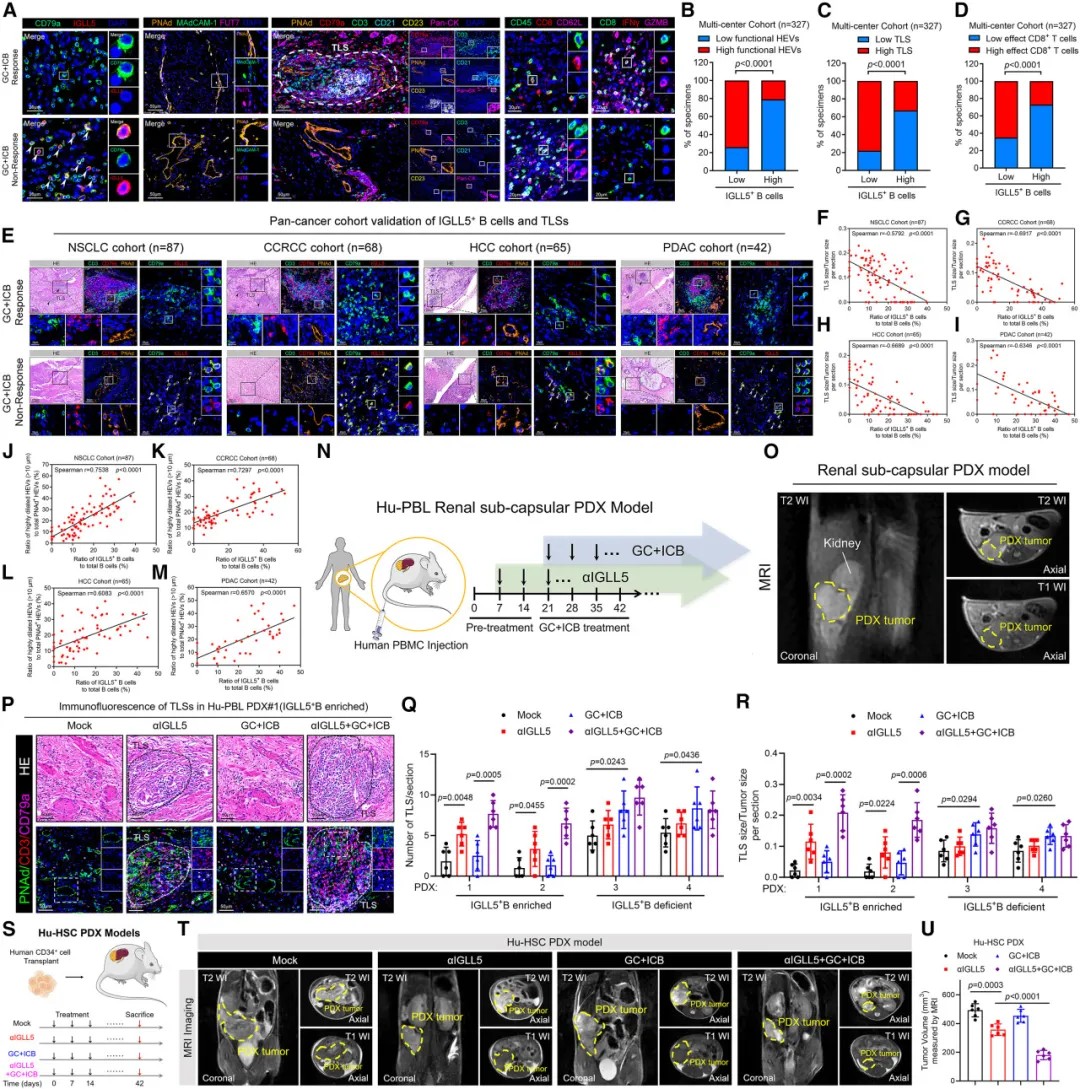
靶向IGLL5+ B细胞可促进三级淋巴结构形成并增强癌症对免疫检查点阻断疗法的应答
临床意义与未来展望
研究团队进一步评估了靶向IGLL5的治疗潜力。在人源化PDX模型中,抗IGLL5中和抗体显著恢复了TLSs形成,并增强了对免疫检查点抑制剂的治疗反应。
重要的是,IGLL5阻断治疗在多种癌症类型的PDX模型中均显示出效果,表明这一机制可能适用于广泛的恶性肿瘤类型。联合使用抗IGLL5和抗PD-1抗体,可产生协同抗肿瘤效应。
与传统的LTβR激动剂相比,IGLL5靶向治疗具有更好的特异性和安全性,避免全身性炎症反应等副作用,为临床转化提供了有利条件。这项研究不仅解开了肿瘤免疫抑制机制的一个重要谜团,更为克服免疫治疗耐药提供了切实可行的策略。(转化医学网360zhyx.com)
原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00545-8
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发