Nat Commun | 重庆医科大学团队揭示肿瘤免疫逃逸新机制,提供双重诊疗新策略
| 导读 | T 细胞功能障碍使肿瘤得以逃避免疫系统,了解其机制对于改进免疫疗法至关重要。 |
近日,重庆医科大学研究团队在期刊《Nature Communications》上发表了研究论文,题为“AEBP1 drives fibroblast-mediated T cell dysfunction in tumors”。本研究中,研究人员通过人类结肠腺癌和三阴性乳腺癌组织的 RNA 测序分析表明,AEBP1的表达与 T 细胞功能障碍呈正相关,并预示着患者预后不良。随后的单细胞 RNA 测序确定癌相关成纤维细胞(CAF)是 AEBP1 的主要来源。AEBP1 可增强 T 细胞的细胞毒性并抑制肿瘤生长。从机制上讲,自分泌 AEBP1 与 CAF 上的 CKAP4 结合,激活 AKT/PD-L1 信号传导,从而导致 T 细胞功能障碍。研究人员确定了 Chem-0199 这种药物,它能破坏 AEBP1 与 CKAP4 之间的相互作用,从而增强抗肿瘤免疫。本研究确立了 AEBP1 是 CAF 介导的 T 细胞功能障碍的关键调节因子,并将其确定为治疗靶点。

https://www.nature.com/articles/s41467-025-63659-w#Sec10
背景知识
01
肿瘤中的 T 细胞功能障碍是一个由肿瘤微环境(TME)内多种机制驱动的复杂过程。导致 T 细胞功能障碍的一个关键因素是 T 细胞上免疫检查点分子的表达,包括程序性细胞死亡蛋白 1(PD-1)和细胞毒性 T 淋巴细胞相关蛋白 4(CTLA-4)。这些分子与其在肿瘤细胞或其他 TME 细胞上的配体相互作用,导致 T 细胞耗竭并降低其抗肿瘤活性。此外,肿瘤相关成纤维细胞(CAF)和其他 TME 细胞分泌的免疫抑制因子进一步抑制 T 细胞功能,阻碍其有效靶向并清除肿瘤细胞的能力。另外,CAF 和 TME 中的细胞外基质(ECM)形成的物理屏障也阻碍了 T 细胞向肿瘤部位的浸润和迁移,加剧了 T 细胞功能障碍。这些机制的相互作用产生了不利的TME,使肿瘤得以持续免疫逃逸,并阻碍了旨在增强 T 细胞介导的抗肿瘤反应的免疫治疗干预措施的效果。理解并靶向这些机制对于克服癌症背景下 T 细胞功能障碍至关重要。
靶向AEBP1的小分子抑制剂Chem-0199增强抗肿瘤免疫
02
为了更直接地探究 AEBP1 在癌症治疗中作为潜在治疗靶点的作用,研究人员通过小分子系统性抑制 AEBP1,以期增强抗肿瘤免疫。研究人员确定了一系列 AEBP1 抑制剂,并选择了 ChemBridge-5340199(以下简称 Chem-0199)进行进一步研究。
接下来,研究人员检测了 Chem-0199 是否能通过 AEBP1/CKAP4 通路在癌相关成纤维细胞(CAFs)中发挥生物学效应。随后,研究人员评估了 Chem-0199 在体内的抗肿瘤活性。接着,研究人员确定了通过免疫检查点治疗(ICT)是否能进一步增强对 Chem-0199 的反应。与在 CAFs 中使用 Aebp1 基因敲除的实验类似,Chem-0199 加上抗 CTLA-4 在抑制 MC38 肿瘤生长方面的效果显著优于单独使用 Chem-0199 或 ICT 治疗。此外,研究人员还研究了 Chem-0199 对肿瘤免疫的影响。在 Chem-0199 治疗组的肿瘤切片中,IFN-γ+ 和 TNF-α+ CD8+ T 细胞的数量明显高于对照组。尤其是,Chem-0199 与 ICT 的联合使用显著增强了 T 细胞的细胞毒性活性,优于单独治疗。研究人员接下来评估了 Chem-0199 在小鼠模型中的体内毒性。苏木精 - 伊红(H&E)染色表明,Chem-0199 对小鼠的心脏、肝脏、肺、肾脏和肠道组织均无明显毒性。
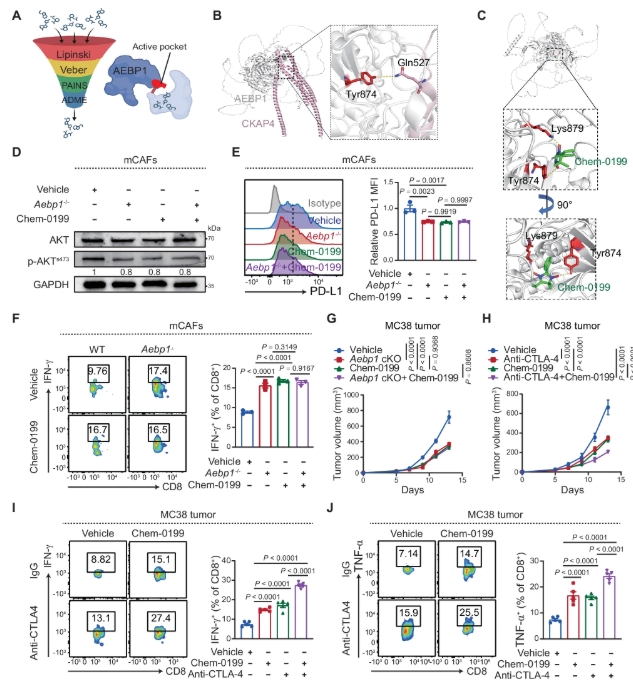
Chem-0199 抑制 AEBP1 与 CKAP4 之间的相互作用
结论
03
总之,本研究揭示了癌相关成纤维细胞(CAF)来源的 AEBP1 以自分泌方式与下游配体 CKAP4 结合,从而触发 PI3K/Akt 通路的激活以及 CAF 上 PD-L1 的上调,最终导致 T 细胞功能障碍。在 CAF 中抑制 AEBP1 的遗传或药物手段可抑制肿瘤进展并增强免疫治疗的效果。这些发现凸显了 AEBP1 在 CAF 介导的肿瘤免疫逃逸中的关键作用,并表明其在癌症治疗中具有作为诊断生物标志物和治疗靶点的潜力。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-025-63659-w#Sec10
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发