华西医院高祥团队:纳米技术在恶性肿瘤诊断和治疗中的研究进展
| 导读 | 本文对纳米技术在恶性肿瘤诊断和治疗中的应用,进行了文献综述和总结。 |
2024年8月12日,四川大学附属华西医院高祥团队在期刊《Signal Transduction and Targeted Therapy》上发表了题为“Current advance of nanotechnology in diagnosis and treatment for malignant tumors”的研究论文。本文重点总结了所有类型的纳米药物,及其在治疗各种癌症中的诊断和治疗用途。

https://www.nature.com/articles/s41392-024-01889-y
研究介绍
01
癌症是全球主要死因之一,每年新诊断病例的发病率约为1,930万,死亡人数约为1,000万。由于其发病率和死亡率的不断增长,它已成为全球延长预期寿命的最大挑战之一。它迫切需要更具突破性的创新和不断改进的策略,以及更好地理解和利用现有的癌症管理策略。
超过一半的癌症患者使用放射疗法,它是最有效的治疗方式之一;但是,减轻短期和长期的毒性,仍然是一个巨大的挑战。传统化疗由于其固有的特性,如不稳定性、不溶性、耐药性和明显的组织损伤,也面临着巨大的挑战。此外,传统的系统给药,使所有体细胞都处于中毒风险中。然而,有一些方法可以减少副作用并避免化疗的缺点,方法是将药物封闭在一个微小的隔室内,将药物吸收到精心设计的孔隙或培养基中,提供相对稳定的微环境,在仿生膜的帮助下实现体内的积极相互作用,并在运输到所需部位后释放药物。这就是纳米技术正在尝试做的事情。
纳米技术与常规肿瘤治疗的结合,不仅可以增强放化疗药物的性能,还可以降低中毒和其他副作用的发生率。监管机构已授权几种治疗性纳米颗粒(NP)平台,例如脂质体、白蛋白和聚合物胶束,用于癌症治疗。这些NPs可以迅速越过人类的生物屏障,即使是有针对性的方式,并持续释放内容物,以保持药物的适当血药浓度。科学界对在NP内制造新制剂的兴趣日益浓厚,它可以避免传统治疗和纳米技术的缺点,并促进临床前和疗效。
同时,除了纳米药物提供的优势外,未来的挑战也值得一提。纳米医学领域主要有两个未解决的问题。增强渗透性和保留EPR是一种被广泛认可的纳米医学常规,尽管EPR已被证实可以降低不良反应的风险,并增强临床前试验和动物模型中的疗效,但其对患者生存结果的改善有限。
本文阐述了各类纳米药物的形态特征、用途和最新进展,纳米医学在恶性肿瘤中的应用,以及在治疗各种肿瘤的优缺点。团队还讨论了纳米技术在恶性肿瘤中的前景和挑战。
研究进展
02
纳米医学在消化系统肿瘤中的应用
纳米技术独特而卓越的性能,可实现多材料负载和诊疗一体化。治疗药物和各种造影剂可以同时封装在纳米颗粒中,实现影像诊断和视觉治疗效果。
Jing等人开发了一种基于细胞外囊泡的纳米探针,该囊泡对肿瘤细胞具有高亲和力。该纳米探针与PET、CT和NIRF成像结合使用,可清晰地可视化原位结肠癌模型,用于引导手术。小鼠肿瘤切除术中的肿瘤位置和边缘,可以通过实时NIRF成像清楚地看到。针对程序化PD-L1和PD-1相互作用对胃癌T细胞诱导的T细胞免疫抵抗,Luo等人将叶酸(FA)和二硫化物(SS)-聚乙二醇(PEG)共轭聚乙烯亚胺(PEI)与超顺磁性氧化铁纳米颗粒(SPIONs)复合物联合,作为PD-L1 siRNA递送系统,可有效靶向胃癌中的PD-L1,并可作为癌症MRI的T2加权造影剂。
诊断性成像也可以与光疗相结合。Zhang等人制备了两亲性JNP NPs,可同时递送亲水性药物(DOX)和疏水性药物(多西他赛)。纳米颗粒具有独立的PH值和近红外灵敏度,有利于控制药物释放。同时,AuNC和Fe(OH)3纳米材料具有CT/MR成像能力,在近红外激光照射下具有化学光热疗法的效果,可产生多重效应,显著抑制肿瘤生长。Zeng等人设计Au@MSNs ICG,是一种基于NIR响应PTT的MSN,并装载了成像诊断剂吲哚菁绿(ICG)。对于肝癌细胞,NPs具有稳定的荧光、生物相容性和NIR/CT信号。NPs在近红外激光照射下能产生精细的温度响应,有利于肿瘤的精准治疗。Qiu等人开发了一种称为三氧化二砷 (ATO)/PFH NPs@Au-cRGD 的药物递送系统。该系统被设计为纳米超声造影剂,通过铁死亡和PTT,实现超声成像和免疫刺激的协同利用。
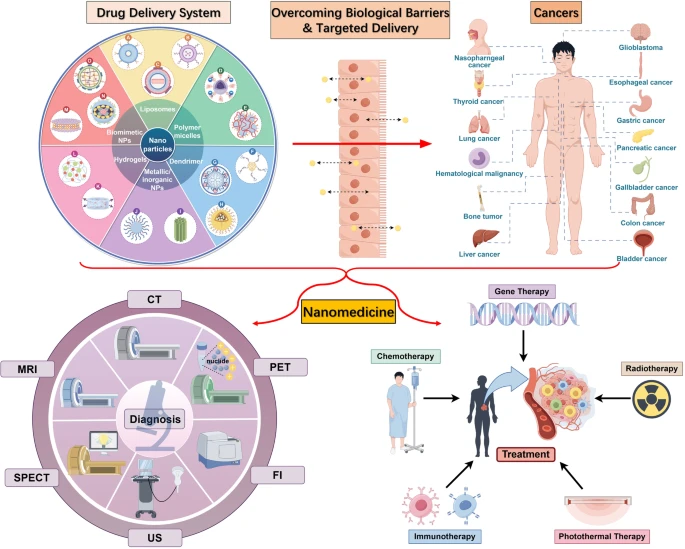
纳米医学在癌症诊断和治疗中的应用。CT计算机断层扫描、MRI磁共振成像、PET正电子发射断层扫描、SPECT单光子发射断层扫描、超声、FI荧光成像。(由 Figdraw 绘制)
纳米医学在肺癌中的应用
一些研究表明,siRNA和NPs上携带的化疗药物的联合治疗,在肺癌的临床治疗中具有巨大的潜力。对于肺癌,尤其是晚期非小细胞肺癌,基于化疗或其他策略的单一疗法缺乏足够的疗效。
有丝分裂停滞缺陷-2(Mad2)是一种重要的有丝分裂检查点基因,与有丝分裂过程中染色体的适当分离有显著相关性。因此,通过siRNA沉默Mad2是一种有吸引力的基因疗法。将靶向Mad2的siRNA将Nascimento封装到聚乙二醇化壳聚糖NPs中,然后与EGFR靶向的CS混合以构建靶向NP系统。研究结果表明,通过siRNA减少Mad2的表达可以克服耐药性,增强肺癌细胞对顺铂的反应性,同时引起最小的毒性。Kirsten ras肉瘤病毒癌基因同源物(KRAS)突变在NSCLC中也很常见。p53功能的丧失,可以加速KRAS衍生的肿瘤发生。因此,恢复p53和抑制KRAS致癌基因是可行的治疗策略。Gu等人将顺铂嵌入脂质体中,然后用含有siR-KRAS和miR-34a的多个聚电解质层构建它们。siR-KRAS可以敲低KRAS癌基因,miR-34a刺激p53功能通路,这种多功能的逐层NP在肺肿瘤中表现出优先摄取,提高了顺铂的作用。由于NP对药物释放的控制,治疗时间延长了。肿瘤进展涉及VEGF促进血管生成,VEGF在许多恶性肿瘤中大量存在。siR-VEGF和依托泊苷等抗血管生成药物,有助于抑制肿瘤。然而,抗血管生成单药治疗的疗效,不理想且不足;VEGF siRNA会受到酶降解的影响,而依托泊苷的溶解度很差。为了解决这个问题,Li等人设计了一种由阳离子脂质体组成的多功能NP,用于共同递送VEGF siRNA和依托泊苷,靶向原位NSCLC。这些NPs可以避免药物泄漏并确保足够的浓度,而这种联合疗法已被证明在体外实验中,具有显著的抗肿瘤作用。
最具侵袭性的NSCLC类型是EML4-ALK基因表达突变的NSCLC。因此,EML4-ALK的突变,已成为NSCLC的独特靶点。SiRNA主要用于抑制ALK mRNA。然而,仅仅抑制ALK mRNA是不够的;因此,miR-301a也与肺癌的进展有关,被认为是一个新的靶点。Li等人制备了一种携带ALK siRNA和miRNA-301抑制剂的金纳米壳基体系,该体系还通过静电吸附涂有DOX。这种递送系统显著增加了血管通透性,因此促进了药物在肿瘤中的积累,这取决于其光热效应和致密的球形结构。最重要的是,它表明该方法基于金纳米壳,具有作为siRNA、microRNA和药物联合靶向治疗的高效平台的潜力。
染料木黄酮天然存在于大豆中,已被证明可以提高某些化疗药物的抗癌作用。MiRNA-29b可以抑制肿瘤细胞的抗凋亡防御或刺激肿瘤细胞凋亡。为了评估染料木黄酮和miRNA-29b联合治疗NSCLC的治疗效果,Sacko等人用MUC 1-适配体构建了染料木黄酮-miRNA-29b负载的功能化杂交NPs(GMLHN)。他们发现,与染料木黄酮或miRNA-29b的单一疗法相比,GMLHN在抑制肿瘤组织增殖方面的作用更好,并且可能的毒性更低。由于染料木黄酮和miRNA通过不同的机制作用于不同的靶点,因此它们基于NPs的组合可以有效下调癌蛋白,如磷酸化蛋白激酶、髓系细胞白血病序列1、磷酸化磷酸肌醇3-激酶等。
使用光敏剂和激光照射产生ROS,使光动力疗法(PDT)成为治疗肿瘤疾病的创新方法。为了获得更好的治疗,有必要将PDT和ROS反应性化疗相结合。Yue等人开发了具有良好生物相容性的NP Ce6-CPT-UCNPs。研究人员已经证实,当暴露于980nm激光辐射时,该纳米颗粒能够产生活性氧(ROS)并释放抗癌药物CPT。Ce6-CPT-UCNPs在原位肺荷瘤小鼠模型和980 nm激光照射后,在原位肺荷瘤小鼠模型和皮下肺癌模型中,均有效积累并抑制了癌症的生长。即使在50天后,肿瘤复发和转移仍未出现。Xia等人设计了基于金纳米团簇的Ce6-DOX-GNCs-MMP2多肽NPs(CDGM NPs)用于成像和联合治疗。他们制备了一种复合物,将光敏剂氯Ce6、化学药物DOX和MMP2多肽的靶向效应,递送至A549细胞中。该颗粒表现出精细的结合效应,可能是肺癌治疗的潜在有效纳米探针。Zhong等人报道了一种新颖且富有创意的NaCeF4:Gd,Tb闪烁体。在该领域,由于光催化活性,铈(Ce)负责ROS的产生,并且还起到敏化剂的作用,帮助Tb离子通过X射线照射释放荧光。此外,Ce离子和Tb离子都可以吸收X射线下二次电子的能量,产生ROS,用于无线电动力学治疗。通过吸收X射线,纳米材料可以帮助CT成像和放射治疗增敏。不仅如此,由于Ce、Gd和Tb离子的重原子,局部辐射剂量沉积在体外也明显增强。在A549小鼠模型中,联合治疗的抗癌效率高于单独放疗。他们的工作主要采用ScNPs来引导多模态成像进入深部肿瘤,这对于进一步的研究和临床应用具有相当大的意义。在肺癌复发转移的情况下,将免疫疗法与光动力疗法相结合,可能是一种相当大的途径。Song等人创造性地设计了PplX-1MT纳米材料,其中可能包括光敏剂PpIX和免疫检查点抑制剂1MT。当受到630nm光的刺激时,纳米材料通过产生ROS诱导癌细胞凋亡,并通过释放1MT来增强免疫系统。它们能够促进CD8 T细胞的活化,显示出更好的治疗效果。
对于早期肺癌,主要的检测方法是螺旋CT。在肺癌的治疗中,近红外荧光(NIRF)成像有助于更好的诊断和治疗,它可以提供高对比度的图像。NIRF分子也可以在手术中用作造影剂,因为它们可以实时明确区分肿瘤区域和正常段。然而,NIRF分子通常会在血液中停留很短的时间。On等人合成了用荧光基团修饰的乙二醇壳聚糖纳米颗粒(CNPs)。这些NPs能够有效地聚集在肿瘤区域。利用纳米材料发出的NIRF信号,在小鼠和兔VX2肺癌模型中准确定位肿瘤。同时,CNPs被用作成像造影剂,用于在图像引导下进行手术。因此,CNPs可用于肿瘤的诊断和治疗。
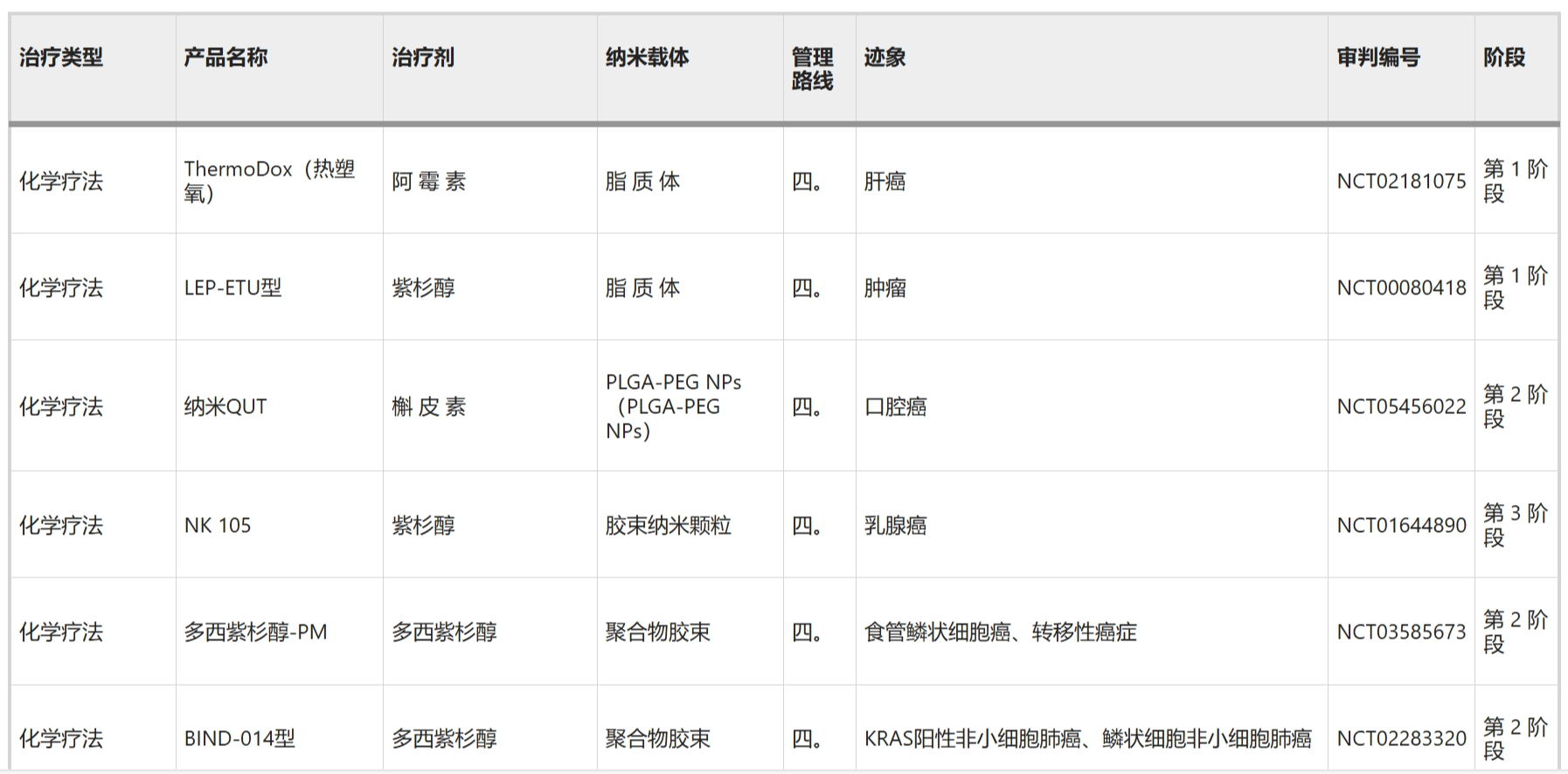
临床试验中的抗肿瘤纳米药物
研究结论
03
前景
纳米医学是一个发展迅速的新兴领域,被认为是解决癌症诊断和治疗问题的一种有前途的策略。癌细胞,尤其是实体瘤的癌细胞,往往高度表达一些受体或配体,用于细胞间物质的运输和识别。科学家可以在了解肿瘤的内在生物学特性的基础上,设计出相应的靶向策略。专为靶向肿瘤细胞而设计的纳米粒子,可以精确检测体内的恶性肿瘤,从而促进癌症的早期诊断和准确定位。这为医疗保健从业者提供了更准确的数据,有助于制定定制的治疗计划,并允许实施综合诊断和治疗策略。纳米技术的卓越性能,使多种材料的负载以及诊断和治疗的集成成为可能。治疗药物和造影剂都可以同时封装在纳米颗粒中,以达到成像、诊断和视觉治疗的效果。
随着材料科学和计算技术的发展,用于装载靶向药物的纳米载体也层出不穷,以满足小分子化疗药物、基因和抗体等的输送需求。纳米复合物可以达到长循环,并以积极或被动的方式到达肿瘤部位。通过将药物载体与纳米颗粒整合,可以实现药物准确输送到肿瘤部位,提高药物的局部浓度,并最大限度地减少对健康组织的不利影响。癌症通常具有特定的肿瘤微环境,这些微环境会在生物标志物上产生明显的变异,这可以作为促进纳米载体到达肿瘤病灶时,药物释放的触发因素。精密的设计,通常可以实现受控的药物释放动力学,以支持在目标时间和位置进行精确肿瘤治疗的需求。纳米技术还可以用于光热疗法和免疫疗法,通过使用纳米材料对肿瘤细胞进行热处理或刺激免疫系统,以消除恶性细胞。
在临床治疗过程中,应始终考虑肿瘤的异质性。同时,也应重视纳米材料在体内进行药代动力学和毒理学分析的必要性,进一步优化药代动力学效应,强化治疗效果。然而,临床方法通常在结合治疗和诊断时表现出滞后效应,这可能导致药物过量和意想不到的不必要影响。药物在体内的实时分布,在静脉给药时也很难监测。在某种程度上,基于纳米技术的载体正在成为以时空节奏方式,提供治疗信息的有前途的策略。
挑战
人们普遍认为,肿瘤微环境(TME)是纳米医学治疗令人失望的结果的原因。包括恶性细胞、肿瘤相关成纤维细胞(CAFs或TAFs)、某些种类的免疫细胞和基质(血管和血管外基质),在癌症的耐药性中起着不可或缺的作用。
尽管纳米药物的主动靶向,在癌症中显示出巨大的潜力,但纳米药物的临床应用仍然不紧不慢。首先,由于临床前和临床研究中的安全性问题,新兴纳米药物的批准率不足10%,生物安全性问题越来越受到关注。
其次,难以找到真正代表人类状况的合适的临床前研究模型,以及缺乏经过验证的纳米颗粒表征分析方法,也是阻碍纳米药物发展的重要因素。
纳米医学的临床转化应始终被视为最终目标。这要求科学家们认真调整原材料、尺寸、表面性能、设计中的电荷、药物负载/封装效率、药物分布以及应用过程中载体的代谢和排泄。在临床转化阶段,纳米药物面临着各种挑战,特别是与药代动力学模型的建立、纳米药物的配方,以及其生物学特性的评估有关的挑战。合理设计纳米药物的理化性质,对于纳米药物免疫逃避、肿瘤外渗和扩散、细胞靶向和内化,以及治疗药物的控释至关重要。生物相容性,目前被认为是临床转化的瓶颈之一。大多数基于纳米技术的药物递送系统,可以在细胞和动物模型中取得良好的结果;然而,由于人体与动物模型有很大差异,临床II-IV试验仍然面临更多挑战。
参考资料:
1.Siegel, R. L., Miller, K. D., Wagle, N. S. & Jemal, A. Cancer statistics, 2023. CA-Cancer J. Clin. 73, 17–48 (2023).
2.Sung, H. et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA-Cancer J. Clin. 71, 209–249 (2021).
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发