再取进展!南京大学等团队合作揭示胃癌进展最新分子机制和治疗靶点
| 导读 | 胃癌(GC)是全球第五常见的癌症,也是与癌症相关死亡的第四大主要原因。 |
3月6日,南京大学汪俊军、中山大学王红胜共同通讯在期刊《Cell Death & Disease》上在线发表题为“The RNA m6A reader IGF2BP3 regulates NFAT1/IRF1 axis-mediated anti-tumor activity in gastric cancer”的研究论文,在这项研究中,研究人员全面调查了m6A阅读蛋白IGF2BP3对GC恶性生物学行为的影响,阐明了其分子机制,并提出IGF2BP3可能是GC进展的新治疗靶点。

https://www.nature.com/articles/s41419-024-06566-0
研究背景
01
胃癌(GC)是全球第五常见的癌症,也是与癌症相关死亡的第四大主要原因。在中国,来自高质量癌症登记处提交的数据估计,2015年全国约有403,000人被新诊断为胃癌,几乎有291,000人死亡。因此,迫切需要开发新型有效的胃癌治疗靶点。
N6-甲基腺苷(m6A)是真核生物mRNA中最丰富的化学修饰。m6A甲基化是一个动态可逆的过程,由甲基转移酶和去甲基化酶调控。m6A结合蛋白能够结合到m6A位点,通过调节其核转运、选择性剪接、降解和翻译来影响mRNA的命运。m6A甲基化的失调已被证实与多种人类癌症的发生有关。报道了m6A甲基转移酶和去甲基化酶的异常表达促进了胃癌的发生和进展。然而,胃癌中m6A阅读蛋白的生物学意义及其潜在的分子机制仍不清楚。
干扰素(IFNs)表现出强大的抗肿瘤作用。干扰素调节因子(IRFs)是干扰素信号调控网络中的关键转录因子(TFs)。作为一种众所周知的肿瘤抑制因子,IRF1在癌细胞中发挥着多种生物学功能,包括抗增殖、诱导凋亡和细胞周期阻滞。在胃癌患者中,IRF1位点显示高频率的杂合性缺失。人类胃癌中观察到IRF-1位点功能失活点突变。然而,m6A甲基化与IRF1之间的相互作用尚未阐明。
活化T细胞核因子1(NFAT1)是主要的NFAT亚型,在免疫系统和炎症反应中发挥重要作用。越来越多证据显示,NFAT1在各种人类癌症中高表达,并通过调节肿瘤细胞增殖、细胞周期、凋亡、迁移和侵袭等过程参与肿瘤发生和进展。
研究发现
02
IGF2BP3在GC组织中表达显著升高,并与GC患者的不良预后相关。IGF2BP3的沉默显著削弱了GC细胞的迁移和克隆能力,促进凋亡,抑制翻译,并抑制了体外生长和进展。机制上,IGF2BP3以m6A依赖的方式调节了活化T细胞核因子1(NFAT1)的mRNA稳定性和翻译。然后,由IGF2BP3诱导的NFAT1作为转录因子(TF)负调控干扰素调节因子1(IRF1)的启动子活性,从而抑制其表达。抑制IGF2BP3诱导的IRF1表达会激活干扰素(IFN)信号通路,发挥其抗肿瘤作用。升高的IGF2BP3通过调节NFAT1/IRF1通路促进了体内外的GC进展。靶向抑制IGF2BP3可能是GC治疗的潜在方法。
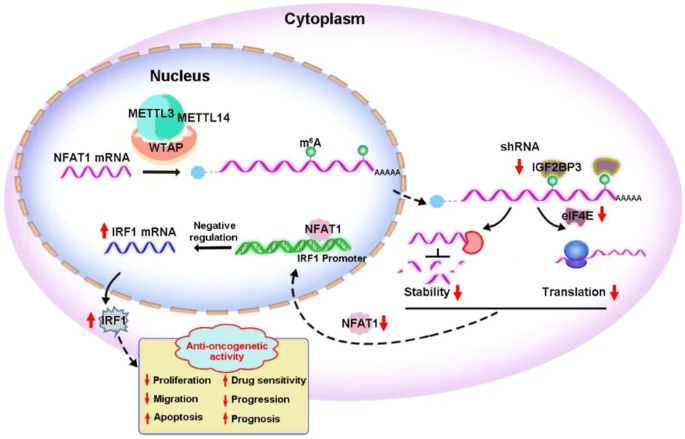
研究结论
03
综上所述,在这项研究中,研究人员全面调查了m6A阅读蛋白IGF2BP3对GC恶性生物学行为的影响,阐明了其分子机制,并提出IGF2BP3可能是GC进展的新治疗靶点。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-024-06566-0
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发