再取进展!张金方课题组揭示“PD-1”调控新机制及其在肿瘤免疫逃逸和治疗中的作用
| 导读 | UFMylation 是一种新兴的泛素样翻译后修饰,可调节各种生物过程。UFMylation 通路的失调会引发各种人类疾病,包括癌症。然而,UFMylation在T细胞中的生理作用仍不清楚。 |
近日,武汉大学医学研究院、教育部免疫与代谢前沿科学中心、中南医院以及泰康生命医学中心张金方课题组在《Molecular Cell》杂志上发表了题为“UFL1 ablation in T cells suppresses PD-1 UFMylation to enhance anti-tumor immunity”的论文。研究揭示了靶向AMPK-UFL1-PD-1信号轴能够增强抗肿瘤免疫,为临床癌症患者提供了潜在的治疗策略。

https://www.sciencedirect.com/science/article/abs/pii/S1097276524000911
研究背景
01
UFMylation 是一种新兴的泛素样 (UBL) 修饰系统,它利用涉及 E1(泛素激活酶 5、UBA5)、E2(UFM1-共轭酶 1、UFC1)和 E3(UFM1-连接酶 1、UFL1,也称为 RCAD、KIAA0776、NLBP 或 MAXER)的三酶级联反应,将泛素折叠修饰物 1 (UFM1) 共价偶联到靶向蛋白质。与对泛素化功能的广泛研究相比,UFM化作用的生理作用探索较少。目前,只有 UFL1 被鉴定为 UFMylation E3 连接酶。UFL1介导的UFM化在调节胚胎发育、内质网(ER)稳态和内质网自噬、DNA损伤反应和病毒感染后干扰素反应中的功能重要性得到了强调。尽管在癌症中已经报道了异常的UFM化,但这些研究主要集中在了解UFMylation的肿瘤内在功能上,UFMylation在肿瘤发生中发挥着矛盾的作用,这取决于不同的癌症类型。尽管 T 细胞在控制肿瘤生长和基于 T 细胞的癌症免疫疗法中起着至关重要的作用,但 T 细胞中 UFMylation 和 T 细胞介导的抗肿瘤免疫的潜在功能仍未得到探索。
免疫细胞,尤其是效应CD8+T淋巴细胞,可以通过抗原定向的细胞毒性来识别和消除癌细胞,强调了免疫系统在对抗癌症中的重要性。然而,由于肿瘤微环境 (TME) 中的 T 细胞功能障碍,肿瘤浸润淋巴细胞 (TIL) 通常无法有效杀死癌细胞。T细胞上上调抑制性免疫检查点受体,如程序性细胞死亡蛋白1(PD-1,也称为PDCD1或CD279)和细胞毒性T淋巴细胞抗原-4(CTLA-4,也称为CD152)是抑制T细胞活化和细胞毒性的机制之一。因此,靶向PD-1和CTLA-4的基于T细胞的免疫疗法已广泛应用于癌症患者的临床治疗。然而,大多数患者对这些免疫疗法没有反应,潜在的耐药机制仍不完全清楚。最近对 PD-1/PD-L1 蛋白表达调控的研究确定了增强抗癌功效的新的潜在治疗策略。多项研究表明,PD-1 蛋白可以通过泛素 E3 连接酶进行泛素化修饰,从而通过蛋白酶体系统降解 PD-1。因此,操纵PD-1的泛素化状态可以控制T细胞中PD-1蛋白的表达水平,从而影响T细胞的细胞毒性功能。
研究结果
02
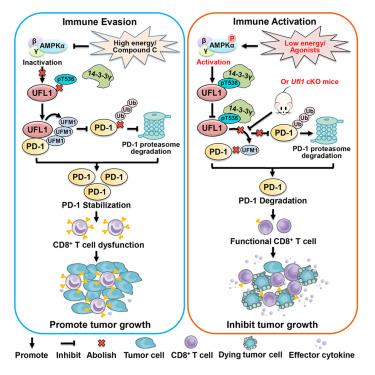
本研究,我们发现与野生型小鼠相比,在T细胞中条件性敲除Ufl1的小鼠(Ufl1cKO)表现出显著的肿瘤抑制现象。此外,单细胞测序数据显示来自Ufl1cKO小鼠的肿瘤,其浸润性细胞毒性CD8+T细胞显著增加。进一步研究表明UFL1能够与PD-1产生直接的相互作用并促进PD-1的UFMylation修饰,以拮抗PD-1的泛素化修饰和降解。而且,我们还发现感受能量代谢的激酶AMPK能够催化UFL1蛋白Thr536位点发生磷酸化修饰,14-3-3γ可以识别AMPK介导的UFL1的磷酸化修饰,破坏UFL1与PD-1的相互作用,导致PD-1不稳定,从而增强CD8+T细胞抗肿瘤免疫。值得注意的是,研究人员不仅证明Ufl1cKO小鼠对CTLA4抗体治疗有更好的响应,还发现使用AMPK激动剂和CTLA-4抗体联合治疗时具有协同抑制肿瘤生长的效果。综上所述,该研究揭示了靶向AMPK-UFL1-PD-1信号轴能够增强抗肿瘤免疫,为临床癌症患者提供了潜在的治疗策略。(转化医学网360zhyx.com)
参考资料:
https://news.whu.edu.cn/info/1015/453047.htm
https://www.sciencedirect.com/science/article/abs/pii/S1097276524000911
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发