【Adv. Sci.】北京大学最新发文:揭示肿瘤细胞生长新机制
| 导读 | 细胞不断感知和响应微环境中的生化和生物力学变化,需要动态代谢适应。ECM硬化是癌症侵袭性的标志,而底物剥离下的生存也与不良预后相关。 |
近日,北京大学研究人员在权威期刊《Advanced Science》上发表了题为“mTORC1 Mediates Biphasic Mechano-Response to Orchestrate Adhesion-Dependent Cell Growth and Anoikis Resistance”的研究论文,本文中,研究人员报道了一种整合素- gsk3 β- fto - mtor轴,它可以整合刚度感知,以确保刚性底物赋予的生长优势和基质剥离下细胞的抗死亡能力。研究表明,底物硬化可以通过整合素和GSK3β-FTO介导的mRNA m6A修饰激活mTORC1,提高mTOR水平,促进合成代谢。在ECM脱离时抑制这条轴增强了自噬,这反过来又传递了肿瘤细胞对肿瘤的弹性,正如在人乳腺导管原位癌(DCIS)和小鼠恶性腹水中所证明的那样。总的来说,这些结果强调了细胞代谢的双相机制调节,在诸如纤维化等硬化条件下的肿瘤生长以及癌症转移期间的抗氧化性中具有重要意义。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202307206
研究背景
01
细胞通过整合素结合的黏着斑(FAs)来感知ECM的物理特性,从而影响细胞的迁移、分化和存活。由于组织纤维化和细胞外基质硬化与肿瘤的不良预后相关,因此通过胶原消耗或赖氨酰氧化酶(LOX)抑制来改变细胞外基质刚度,或通过药物改变细胞力学转导已成为有前景的癌症治疗选择。然而,肿瘤细胞也表现出对失巢凋亡(ECM脱离诱导的细胞死亡)的抵抗。肿瘤细胞如何在坚硬的基质上获得生长优势,同时在基质脱离后抵抗细胞死亡仍然是一个谜。
细胞生长和增殖与细胞合成代谢密切相关。耐氧性也与代谢适应同时发生,可被自噬所阻碍。雷帕霉素复合体1 (mTORC1)的机制靶点是响应细胞内和细胞外信号的代谢调节的中心支柱。它的激活与增强蛋白质翻译和减少自噬有关。mTORC1被招募到溶酶体表面释放其抑制作用。最近的研究表明,溶酶体mTORC1可以被运输到FAs周围并被激活,FAs是连接ECM与细胞内部的基于整合素的机械转导中心。然而,仍然缺乏证据表明基质的物理性质是否可以信号传导到mTORC1通路。
研究进展
02
机械力广泛参与各种生物过程,包括细胞增殖、分化和迁移需要代谢重组。作为合成代谢的主要调节因子,mTORC1一直是细胞生长和肿瘤生存研究的重点,然而,其与机械微环境的关联在很大程度上缺失。
基于整合素的FAs是一种动态蛋白复合物,介导肌动蛋白细胞骨架与ECM的结合,并通过经典的机械转导途径在功能上参与细胞极化、扩散和迁移。最近的证据表明生长因子受体和氨基酸转运蛋白在FA位点的分布。此外,在FA富集的细胞区域也发现了本地化的蛋白质翻译。在机械传感方面,FAs的新作用将被揭示。在这里,研究人员发现mTOR和phos-S6可以通过整合素- fa位点的局部激活来促进细胞增殖和抑制自噬。这种激活依赖于底物感知、细胞收缩以及整合素β1。这些观察一致表明了整合素共轭FAs在调节细胞代谢中的作用。
研究人员鉴定了fto - m6A去甲基化酶之一,它对mTOR mRNA和随后的蛋白丰度的机械调节至关重要。近年来,FTO的翻译后修饰(PTMs)受到越来越多的关注。据报道,150个磷酸化位点显著改变了FTO的亚细胞定位和底物特异性。此外,蛋白激酶Cβ (PKCβ)的磷酸化引导FTO参与泛素介导的蛋白降解。在本研究中,研究人员发现丝氨酸256位点的磷酸化阻碍了FTO的催化活性,但不影响其亚细胞定位或蛋白丰度,表明PTMs通过多种方式影响FTO。不同硬度下FTO活性改变的一种可能性是,磷酸化通过先前报道的Ca2+结合增强来修饰FTO活性。另一种可能是磷酸化状态通过影响FTO的寡聚化来改变其活性,然而,由于FTO结构的复杂性和技术的局限性,确定二聚化对FTO催化活性的确切影响并不容易。
本研究揭示了mTORC1通路的机械激活可能在硬度促进细胞生长和抗失巢凋亡方面发挥双重作用。增加的基底刚度或细胞张力增强了mTORC1的激活,维持细胞增殖和合成代谢。而ECM脱离则使mTORC1信号失活,并通过提高自噬促进细胞存活。肿瘤细胞如何利用这一机制在力学-微环境的变化中前行,以及这一通路如何有助于靶向治疗,有待未来的研究。
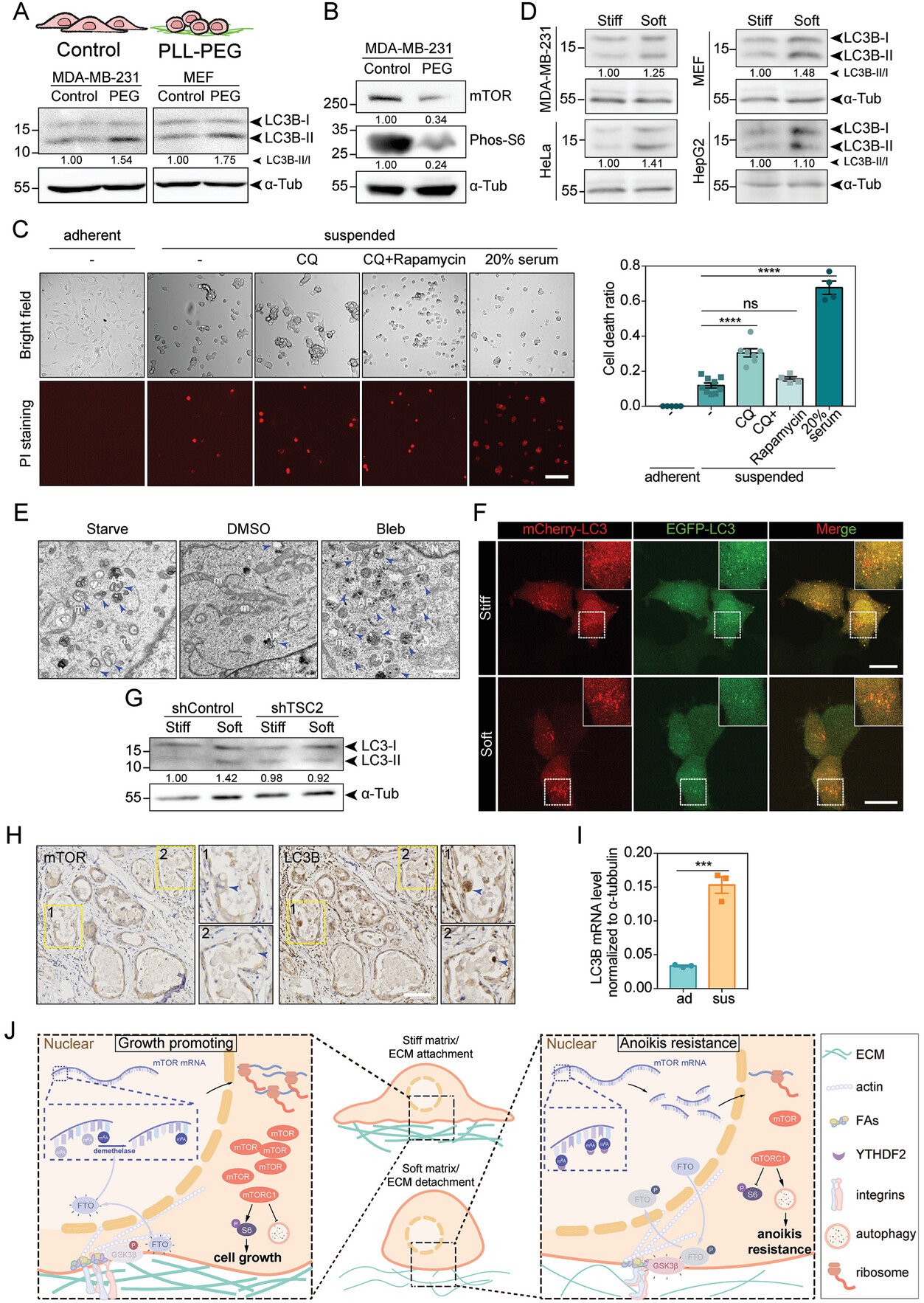
底物刚性通过mTORC1途径调节自噬
研究结论
03
综上,研究人员发现了mTORC1途径在坚硬基质或底物脱离时的机械调节现象和潜在机制。研究结果表明,肿瘤细胞利用细胞代谢的双相机械调节来协调细胞在坚硬基质上的生长和在底物脱离时的抵抗。靶向整合素- gsk3 β- fto - mtor轴可能揭示癌症的双重打击策略。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202307206
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发