协同抗癌,减弱毒性副作用!川大华西学者发布抗击胃癌新策略
| 导读 | 联合化疗和靶向治疗在晚期胃癌(GC)的治疗中具有巨大的潜力。GC 组织表现出蛋白激酶 B(AKT)表达水平升高,导致化疗反应性差并加速疾病进展。 |
11月12日,四川大学华西医院罗奎、胡建昆共同通讯在《Advanced Science》上发表题为“Enzyme-Responsive Branched Glycopolymer-Based Nanoassembly for Co-Delivery of Paclitaxel and Akt Inhibitor toward Synergistic Therapy of Gastric Cancer”的研究论文,研究证明了通过 AKT 抑制剂 capivasertib (CAP) 抑制 AKT 表达以增强紫杉醇 (PTX) 对 GC 细胞的细胞毒性。组织蛋白酶 B 响应性聚合物纳米颗粒前药系统用于 PTX 和 CAP 的共同递送,从而产生聚合物纳米药物BPGP@CAP。PTX 和 CAP 的释放是在溶酶体摄取 BPGP@CAP 时在组织蛋白酶 B 过表达的环境中触发的。PTX 和 CAP 对杀死 GC 细胞的协同治疗作用已通过体外和体内实验得到证实。机理研究表明,CAP可能抑制AKT表达,导致磷酸肌醇3-激酶(PI3K)/AKT信号通路的抑制。令人鼓舞的是,CAP可以与PTX协同作用,在通过聚合物药物递送系统共同递送后对GC发挥强大的抗肿瘤作用,并且该递送系统有助于减少其毒副作用,这为治疗GC提供了有效的治疗策略。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202306230
研究背景
01
据报道,AKT抑制剂和化疗药物的组合可以协同触发细胞凋亡并阻碍肿瘤生长。Capivasertib (CAP) 是一种高效的泛 AKT 激酶抑制剂,对三种不同亚型的 AKT 具有相当的抑制作用。CAP 抑制 AKT 底物的磷酸化,从而阻断 PI3K/AKT 信号通路。结果,细胞的生长受到抑制,细胞凋亡得到促进。[然而,一些局限性,如水溶性差和生物利用度低,限制了其广泛应用。令人鼓舞的是,PTX 和 CAP 的联合治疗已被证明可以增强 PTX 诱导的肿瘤细胞凋亡水平,表明它们的组合可以为治疗GC提供一种有前途的新方法。据报道,患者可以耐受AKT抑制剂和化疗药物的组合,但是,他们患有严重的毒副作用,如腹泻、感染、中性粒细胞减少、皮疹和疲劳,这可能归因于他们的药代动力学欠佳和在体内的生物分布不良。因此,人们一直在寻求递送AKT抑制剂和化疗药物的有效方法,以达到有效的组合治疗效果并减少其副作用。
研究进展
02
本研究提出了一种创新方法,利用2-乳糖酰胺乙基甲基丙烯酰胺(LAEMA)作为支链糖聚合物的关键构建单元,设计和制备了用于PTX和CAP的酶响应纳米药物递送系统。该系统旨在精确靶向肿瘤细胞并控制PTX和CAP的释放。如图1所示,通过RAFT聚合和巯基-烯点击反应制备了基于LAEMA的支链聚合物骨架作为PTX前药。这些框架表现出自组装特性,并在自组装过程中用于封装 CAP。在遇到肿瘤细胞时,由于溶酶体中存在过表达的组织蛋白酶B,纳米药物系统发生快速崩解,从而释放PTX和CAP。这种双药策略对GC表现出显着的协同作用:PTX通过抑制有丝分裂和诱导细胞凋亡来阻碍肿瘤细胞增殖,CAP通过抑制PI3K/AKT通路来抑制肿瘤细胞生长并促进细胞凋亡。通过纳米递送系统实现的令人鼓舞的治疗增强强调了这种双药共递送方法的潜力,即通过结合化疗和AKT抑制来推进GC治疗的有前途的治疗途径。
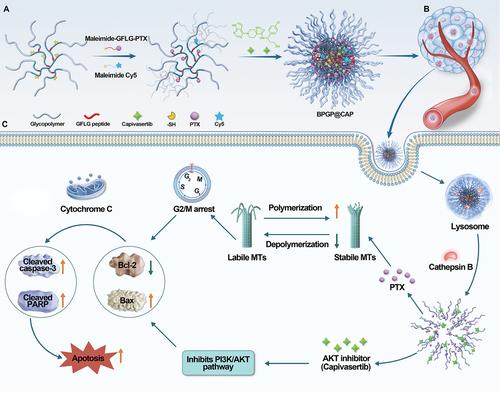
酶响应性支链糖聚合物纳米组装体(BPGP@CAP)用于协同抗肿瘤治疗的示意图。支链聚(LAEMA)-GFLG-PTX前药通过疏水-亲水相互作用自组装,该前药将CAP封装为AKT抑制剂,形成稳定的纳米组装体,BPGP@CAP。通过增强的渗透性和保留 (EPR) 效应,BPGP@CAP选择性地积聚在肿瘤组织上。在肿瘤细胞内,过表达的组织蛋白酶B触发聚合物结构中GFLG肽的特异性裂解,导致载体降解和伴随的药物释放。释放的 PTX 和 CAP 通过诱导细胞凋亡协同发挥抗肿瘤作用。
研究结论
03
本研究建立了组织蛋白酶B反应性药物递送系统,利用可控的RAFT聚合和高效的点击化学方法共同递送PTX和CAP,旨在实现化疗和靶向治疗GC联合治疗的协同治疗效果。BPGP@CAP纳米组装能够通过EPR效应将PTX和CAP靶向递送至肿瘤部位,并在智能响应肿瘤细胞溶酶体中过表达的组织蛋白酶B后,从BPGP@CAP中精确释放PTX和CAP。释放的CAP抑制AKT及其下游PI3K/AKT通路的表达,并与释放的PTX协同作用,发挥增强的抗肿瘤作用。同时,PTX和CAP在这种基于糖聚合物的药物递送系统中递送后,毒性显著降低。因此,这种基于糖聚合物前药的酶响应纳米药物可用于多种治疗药物的共递送,为GC治疗提供了一种新的方法。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202306230
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录








还没有人评论,赶快抢个沙发