“铜抗癌”再添实例!国内团队研究发现促进肝癌进展的新机制
| 导读 | 铜负荷引起的铜凋亡是由一种新的调节机制介导的,这种机制不同于先前记录的调节细胞死亡的机制。依赖线粒体呼吸的细胞显示出对铜离子载体伊利司莫的敏感性增加,从而诱导铜凋亡。母体胚胎亮氨酸拉链激酶(MELK)通过PI3K/mTOR通路促进肿瘤发生和肿瘤进展,然而,MELK在铜凋亡中的作用尚不清楚。 |
近日,山东大学/山大齐鲁医院/山东省第二人民医院(山东省耳鼻喉医院)研究人员在期刊《Cell Death&Disease》上发表了题为“MELK promotes HCC carcinogenesis through modulating cuproptosis-related gene DLAT-mediated mitochondrial function”的研究论文, 本研究中,研究人员证实,MELK表达升高可增强PI3K/mTOR信号的活性,进而促进二氢脂酰胺s -乙酰转移酶(Dihydrolipoamide S-Acetyltransferase, DLAT)的表达并稳定线粒体功能。这种调节作用有助于改善线粒体呼吸,消除细胞内过多的活性氧(ROS),减少细胞内氧化应激/损伤和线粒体诱导的细胞命运改变的可能性,最终促进HCC的进展。综上所述,MELK通过激活PI3K/mTOR通路,提高铜凋亡相关特征(CRS)基因DLAT的水平(尤其是DLAT单体的比例),从而促进伊利司莫耐药,改变线粒体功能,最终促进HCC进展。

https://www.nature.com/articles/s41419-023-06264-3#Sec26
研究背景
01
原发性肝癌是全球第六大最常诊断的癌症,也是导致癌症死亡的第三大原因。肝细胞癌(HCC)约占原发性肝癌的80%,由于其迅速上升的死亡率,最近受到了相当大的关注。尽管HCC的治疗在过去十年中取得了很大的进展,但这一患者群体的预后仍然令人失望,部分原因是大多数HCC患者在诊断时为晚期癌症,手术或局部治疗不可行。此外,它是一种异质性疾病,对放疗反应有限,化疗耐药高。此外,尽管多激酶抑制剂或免疫检查点抑制剂(ICIs)已成功应用于治疗HCC,但这些药物对HCC患者的生存益处仍然令人失望。因此,进一步研究HCC的进展机制是开发新的治疗方法的必要条件。
母胚亮氨酸拉链激酶(MELK)是丝氨酸/苏氨酸激酶Snfl/AMPK家族的成员。MELK是一种新型的致癌基因,它与多种细胞功能有关,包括致癌、增殖、凋亡、干性和代谢,近年来在癌症生物学、干细胞和代谢领域受到广泛关注。此外,线粒体在决定肿瘤干性和肿瘤命运中的关键作用已被越来越多地认识到。最近的研究表明,MELK通过激活PI3K/mTOR级联参与肿瘤发生和肿瘤进展。MELK过表达促进肿瘤增殖、迁移、干性和Akt/mTOR信号活性。细胞代谢的改变将肝癌细胞与正常健康细胞区分开来,这被认为是癌症的十大标志之一。能量生产的改变有助于癌细胞保持高增殖率。因此,靶向改变肿瘤代谢可能是一种潜在的肿瘤治疗方法。
研究发现
02
铜是动物体内酶的重要辅助因子,即使在适度的细胞内浓度下也可能最终导致细胞死亡。肝脏是人体铜代谢的重要器官。已经证实,肝硬化增加了对HCC的易感性,与健康肝脏相比,存在一定程度的铜积累。由于铜具有诱导氧化应激的潜力,铜稳态的变化可导致多种危及生命的疾病。此外,铜可以通过直接靶向TCA循环的组分,显著降低肿瘤细胞的备用呼吸能力,从而促进铜凋亡。铜负荷引起的铜凋亡是由一种新的调节机制介导的,这种机制不同于先前记录的调节细胞死亡的机制。最近的研究表明,依赖线粒体呼吸的细胞对铜离子载体伊利司莫的敏感性增加,导致铜还原。此外,在多种细胞中,包括癌症干细胞、耐药细胞和线粒体代谢增强的细胞中,已经有文献记载了伊利司莫的显著抑制作用。有趣的是,铜凋亡对线粒体呼吸的上述影响与HCC中的MELK沉默相似。因此,研究人员假设MELK与HCC细胞中的铜凋亡通路之间可能存在相互作用,从而促进HCC的进展。
此外,结合铜凋亡相关特征对shMELK数据集进行了深入分析,并利用Broad研究所DepMap门户网站的数据进行了相关实验验证。最终鉴定出1个铜凋亡相关关键基因DLAT。伊利司莫诱导的凋亡是癌症研究和治疗中的一个重要发现。铜离子载体伊利司莫被认为是一种靶向线粒体代谢的抗癌药物。伊利司莫可促进DLAT低聚物的增加,这是其毒性作用的原因,并最终导致铜凋亡。为了探索MELK和细胞铜凋亡之间的潜在关联,进行了后续实验。研究人员证实MELK在HCC组织中高表达。MELK表达升高可增强PI3K/mTOR信号活性,进而促进DLAT表达,稳定线粒体功能。这种调节作用有助于改善线粒体呼吸,消除细胞内过多的ROS,减少细胞内氧化应激/损伤和线粒体诱导的细胞命运改变的可能性,最终促进HCC的进展。同时,结果表明,伊利司莫处理降低了TOM20的表达,增加了DLAT低聚物。此外,在体外和体内,伊利司莫可以消除MELK对HCC的上述变化。
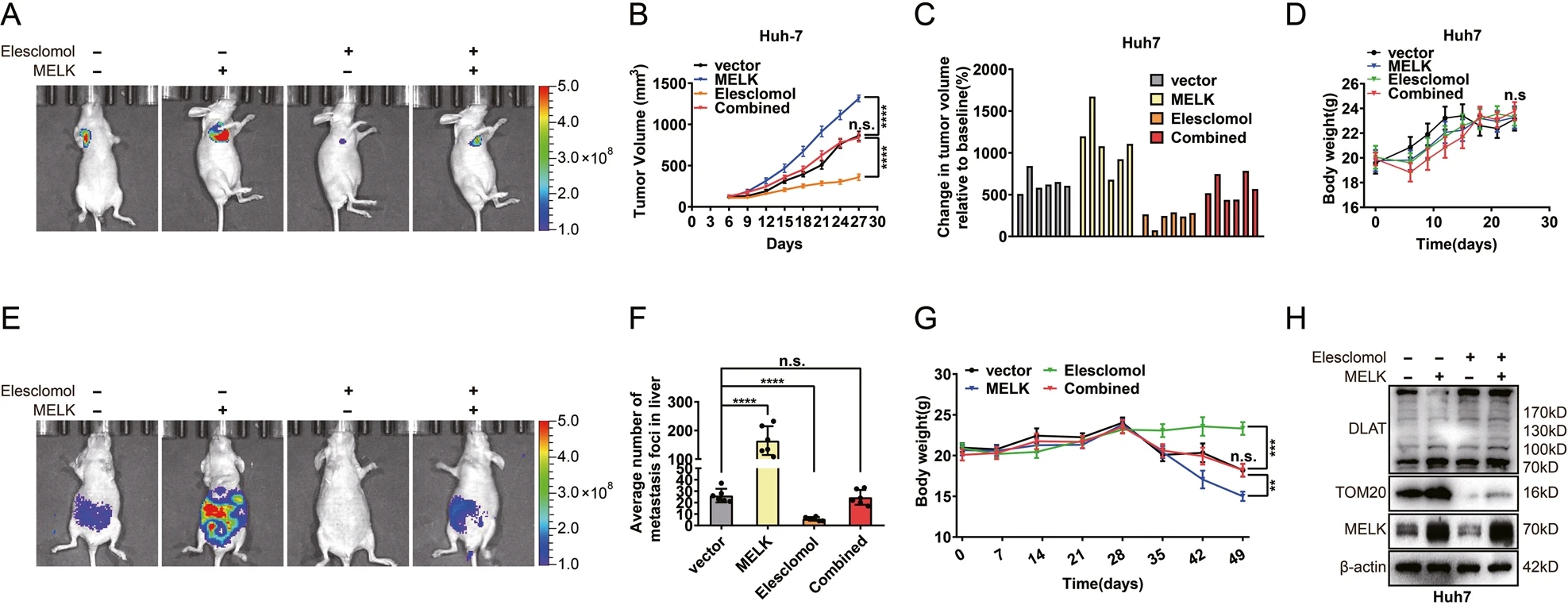
在MELK诱导的肝细胞癌体内进展中,铜凋亡相关途径必不可少
研究结论
03
总之,MELK或/和DLAT的高表达是HCC的不良预后指标。本研究提供了迄今未见的证据,表明MELK诱导的线粒体功能改变可能参与了HCC的癌变。此外,研究人员发现MELK通过激活PI3K/mTOR信号通路,提高CRS基因DLAT的水平,从而促进伊利司莫耐药,改变线粒体功能,最终加速HCC的进展。这些发现完善了研究人员对MELK诱导的癌变机制的理解,并提示靶向MELK/ dlat介导的线粒体途径可能是治疗HCC的潜在策略。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-06264-3#Sec26
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发