“高达90%靶基因沉默”!温医大研制出明显抑制胰腺肿瘤的纳米机器
| 导读 | 多组分脱氧核酶(MNAzymes)在基因治疗中具有巨大的潜力,但其识别疾病组织并进一步实现协同基因调控的能力却很少被研究。 |
近日,温州医科大学张洪波、沈贤、孙维建研究团队在权威期刊《Nature Communications》上发表了题为“An autocatalytic multicomponent DNAzyme nanomachine for tumor-specific photothermal therapy sensitization in pancreatic cancer”的研究论文,该研究以DSPE疏水内核制备了精氨酸酰甘氨酸(RGD)修饰的二硬脂酰酰基磷脂酰乙醇胺(DSPE)-聚乙二醇(DSPE-PEG-RGD)胶束,以负载光热治疗(PTT)染料IR780和钙外排泵抑制剂姜黄素。然后,MNAzyme被分布到亲水的PEG层中,并通过生物矿化作用被磷酸钙密封。此外,RGD附着在PEG的外尾,用于肿瘤靶向。构建的纳米机器可以在酸性条件下释放MNAzyme和辅因子Ca2+,并通过消耗致癌基因miRNA-21自组装进入活性模式,裂解热休克蛋白(HSP) mRNA。沉默miRNA-21增强肿瘤抑制基因PTEN的表达,导致PTT致敏。同时,姜黄素维持高水平的细胞内Ca2+,通过破坏线粒体Ca2+稳态进一步抑制热蛋白伴侣蛋白ATP。因此,胰腺癌对ir780介导的PTT具有三重致敏性。体外和体内实验结果表明,基于mnazyme的纳米机器能强烈调节HSP和PTEN的表达,并在激光照射下对胰腺肿瘤有明显的抑制作用。

https://www.nature.com/articles/s41467-023-42740-2#Sec3
研究背景
01
轻度光热疗法可以避免癌症治疗过程中因过度高温引起的炎症和肿瘤转移。然而,轻度PTT的疗效受到细胞热防御机制产生的热休克蛋白(HSPs)的显著影响。HSP小分子抑制剂与光热剂的结合被认为是一种有效的PTT策略。然而,小分子抑制剂通常有明显的滞后效应,因为它们只能抑制已经产生的热休克蛋白,而不能在治疗前阻止热休克蛋白的产生。此外,小分子抑制剂将不可避免地抑制肿瘤周围组织中的热休克蛋白;因此,PTT过程中不可避免的热扩散会加剧肿瘤治疗的副作用。更重要的是,不仅针对HSPs,还针对PTT相关的靶标,如ATP和miRNA-21,也可能产生协同效应。因此,实现PTT对特定癌细胞的多水平致敏具有重要意义。
多组分脱氧核酶(MNAzymes)是由两种最广泛使用的DNAzymes (17E和10-23)进一步设计发明的,它们包含两个通过在催化核心分裂DNAzyme而产生的部分酶链。激励人心的是,最近的一项研究已经证明了使用miRNA进行MNAzymes的自组装以实现肿瘤靶向递送的潜力。然而,对miRNA沉默以进一步提高治疗效果的研究一直被忽视。此类研究的缺乏代表了目前对MNAzyme治疗概念的理解存在重大差距,因此需要在未来的研究中进一步探索。
研究过程
02
在这项研究中,研究人员构建了一个靶向mir-21的mnazyme驱动的HSP70 mRNA切割机制,以抑制PTT治疗前HSP70的产生。研究人员制备了肿瘤靶向肽RGD修饰的DSPE-PEG2k胶束,用于装载线粒体靶向PTT染料IR780和Ca2+外排泵抑制剂姜黄素(简称RM(I+C))。MNAzyme利用磷酸钙在胶束体系的PEG层上矿化,形成最终的纳米器件RM(I+C)@CaP(P)。细胞内化后,CaP产生大量Ca2+用于溶酶体逃逸。因此,一些酶消耗miRNA-21并在肿瘤组织中自组装成Ca2+辅助mnazyme驱动的HSP70 mRNA沉默机器,同时在健康组织中保留HSP70的保护作用。miRNA-21的沉默使PTEN表达上调,同时也使肿瘤组织敏感,提高PTT效率。对ir780介导的PTT的进一步敏化是通过Ca2+诱导的多通道线粒体破坏来完成的,这是由于姜黄素介导的钙外流泵抑制和癌细胞内质网(ER)的Ca2+释放。锌的加入阻止了无定形CaP向羟基磷灰石的相变,提高了纳米配方在储存过程中的稳定性。最后,研究人员在原位胰腺癌模型中证明了MNAzyme系统选择性调节肿瘤组织和邻近组织的能力。
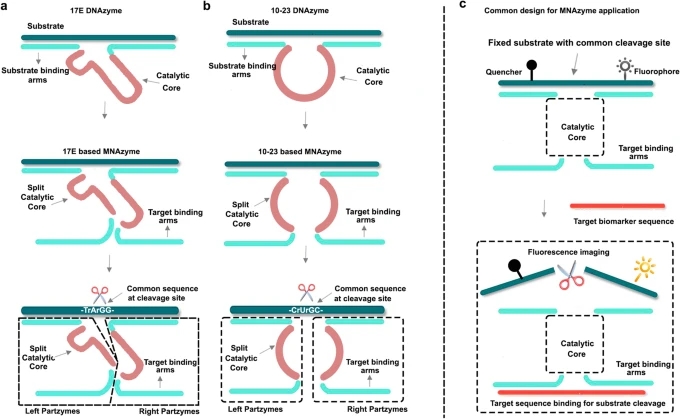
MNAzymes的结构
研究结论
03
综上,研究人员成功地构建了一个智能纳米机器,用于多模块协同光热治疗,具有区分肿瘤和癌旁组织的能力。体内实验证实,纳米机器在处理生物信号(miRNA-21)后,仅在肿瘤细胞中激活并特异性调节HSP70 mRNA,而在健康细胞中保持HSP保护功能。此外,该系统突破了MNAzyme设计的刻板印象,同时利用miRNA/partzyme复合物的空间阻断机制以及多周转催化率,实现了高达90%的靶基因沉默。同时,利用Ca2+构建纳米载体,解决了内源性金属辅助因子不足的问题。这种多协同的纳米机器有望促进MNAzymes在癌症临床治疗中的应用。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-42740-2#Sec3
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发