最新突破!南京医科大学/南京大学/复旦大学发现铁死亡抵抗新机制 揭示肿瘤治疗新策略
| 导读 | 导读:实体瘤对铁死亡具有很强的耐药性。然而,实体瘤中铁死亡抵抗调控的机制仍不清楚。 |
近日,南京医科大学/南京大学/复旦大学研究人员在国际权威期刊《 Cell Reports》 发表了题为“HIF-1α drives resistance to ferroptosis in solid tumors by promoting lactate production and activating SLC1A1”的研究论文。本研究确定了缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)是缺氧条件下实体肿瘤铁死亡抵抗的主要驱动因子,其通过调节糖酵解和谷氨酸代谢共同促进肿瘤细胞铁死亡抵抗。本研究还进一步确定了 HIF-1α 抑制剂和铁死亡诱导剂(FIN)联合治疗可作为一种新的有效的实体肿瘤治疗策略。

https://doi.org/10.1016/j.celrep.2023.112945
研究背景
01
铁死亡是一种不同于细胞凋亡、细胞坏死和自噬的新型铁依赖性程序性细胞死亡类型。在铁死亡中,二价铁或酯氧化酶催化细胞膜上大量存在的不饱和脂肪酸氧化,诱导脂质过氧化,从而诱导细胞死亡。SLC7A11-GPX4轴作为铁死亡抵抗中最重要的系统,已被广泛表征。谷胱甘肽过氧化物酶4 (GSH peroxidase 4, GPX4)是一种谷胱甘肽过氧化物酶,利用谷胱甘肽解毒脂质过氧化物,抑制铁死亡。
鉴于肿瘤细胞异常血管化与高氧消耗之间的不平衡导致实体肿瘤微环境(TME)中广泛存在缺氧,缺氧紧密调节肿瘤细胞凋亡、化疗耐药、侵袭、免疫逃逸等诸多方面的生物学功能。为了在缺氧条件下存活和增殖,肿瘤细胞必须迅速经历从氧化磷酸化到糖酵解的代谢转换,以维持缺氧条件下的氧化还原稳态。鉴于TME缺氧与肿瘤细胞存活之间的相关性,一些开创性的研究已经研究了缺氧对铁死亡的调节。然而,尽管这些研究通过铁代谢的改变成功地将铁死亡与缺氧联系起来,但缺氧诱导因子、糖酵解和谷氨酸代谢在肿瘤细胞耐铁死亡中的调节作用尚未完全明确。
研究过程及发现
02
研究人员证明了HIF-1α是乏氧下实体肿瘤铁死亡抵抗的主要驱动因素。机制研究进一步提示,HIF-1α通过两条途径促进肿瘤铁死亡抵抗:(1)诱导细胞代谢向糖酵解转变,导致大量乳酸的产生;(2)上调SLC1A1表达,调节谷氨酸代谢。
研究人员在铁蛋白缺失细胞和KO细胞中检测了缺氧驱动的铁衰亡抵抗,并且在缺氧条件下仍然观察到对铁衰亡的抵抗,这表明存在与铁代谢平行的缺氧驱动铁衰亡抵抗机制。
为了确定HIF-1α和HIF-2α在缺氧驱动的铁死亡抵抗中的作用,研究人员制造了HIF-1α/HIF-2α单个KO和DKO细胞。与先前的研究一致,研究人员发现HIF-2α确实赋予肿瘤细胞对铁死亡的敏感性。
有研究表明,乳酸具有抑制癌细胞铁死亡的作用。然而,乳酸盐的作用仅在正常缺氧条件下进行了研究。研究结果表明,乳酸对低氧条件下小鼠的抗铁死亡作用明显强于正常氧条件下小鼠。研究人员通过调节肿瘤细胞中乳酸生成促进酶LDHA/B的表达来改变乳酸水平,并检测了缺氧条件下肿瘤细胞对铁死亡的抵抗力的相关增减。通过基因KO模型,研究人员发现肿瘤细胞中乳酸介导的铁死亡抗性不依赖于经典的介导铁死亡抗性的SLC7A11和FSP1系统。
研究人员发现高水平的乳酸会造成酸性环境。与HCl所创造的环境相反,乳酸诱导的酸性环境促进了对铁死亡的抵抗力。因此,研究结果表明,乳酸的产生,特别是通过乳酸诱导的酸性微环境,是HIF -1α驱动的肿瘤细胞在缺氧条件下抵抗铁死亡的独立机制。
SLC7A11-GPX4轴和FSP1-ubiquinol轴是两个众所周知的抑制铁死亡的系统。为了确定这些经典系统是否参与了缺氧驱动的铁死亡抵抗,研究人员在slc7a11和fsp1敲除的肿瘤细胞中检测了缺氧诱导的铁死亡抵抗。与之前的研究一致,去除SLC7A11或FSP1并不影响基线细胞活力,但可有效诱导细胞对rsl3诱导的铁死亡的敏感性。
研究人员发现SLC1A1,一个膜谷氨酸转运体,通过将细胞外的谷氨酸回收到细胞中来驱动slc7a11介导的胱氨酸摄取,可能参与了在缺氧条件下增强胱氨酸摄取。研究结果表明,HIF-1α作为转录因子促进SLC1A1的上调,促进胱氨酸的摄取。也就是说,研究人员发现SLC1A1是一种新型的促进铁死亡抵抗的分子,其机制依赖于经典的谷氨酸-胱氨酸交换轴。
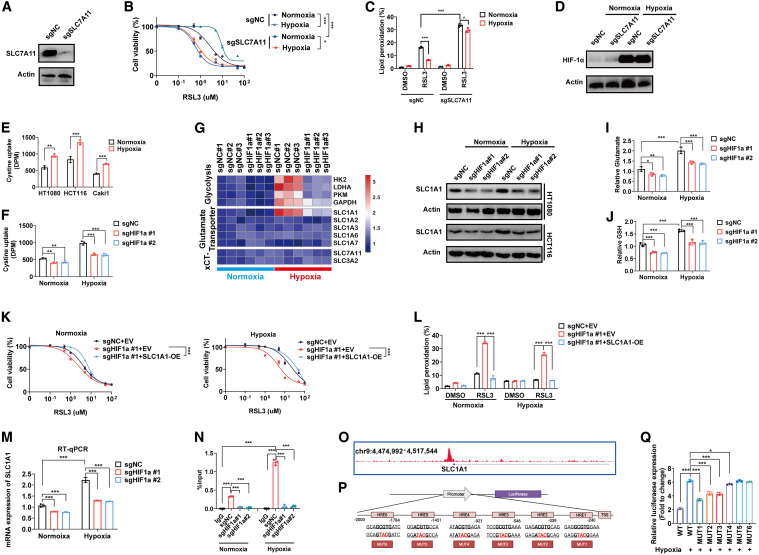
HIF-1α通过上调谷氨酸转运体SLC1A1促进slc7a11介导的胱氨酸摄取
研究证实,电离辐射(IR)可诱导癌细胞发生铁死亡,提示缺氧驱动的铁死亡抵抗可能是肿瘤对放疗抵抗的一个因素。此外,细胞毒性CD8+ T细胞在免疫治疗过程中诱导肿瘤细胞铁死亡,支持诱导肿瘤细胞铁死亡是实体瘤的有效治疗策略的观点。研究人员使用PDX和CDX模型进行的临床前研究表明,HIF-1α抑制剂地高辛使肿瘤细胞对FIN SAS敏感。与这一发现一致,地高辛与SAS联合治疗对肿瘤生长的抑制效果优于单独使用任何一种药物或临床常用的治疗药物。
研究意义
03
综上,研究人员证实实体肿瘤中缺氧微环境是导致铁死亡抵抗的主要因素,而缺氧诱导因子 HIF-1α 是其主驱动器。HIF-1α 抑制剂联合铁死亡诱导剂可成为实体肿瘤治疗的新策略。这些发现不仅阐明缺氧诱导实体肿瘤铁死亡抵抗的分子机制,同时为实体肿瘤的治疗提供新的理论和策略。(转化医学网360zhyx.com)
参考资料:
https://doi.org/10.1016/j.celrep.2023.112945
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发