协同杀死结直肠癌细胞!同济大学提出治疗新策略!
| 导读 | 随着测序技术的发展,人们逐渐认识到瘤内细菌在癌症进展中的关键作用。目前已发现多种瘤内细菌是诱导癌症进展、转移和不良预后的癌症病原体,而肿瘤血管网络和免疫抑制微环境则为病原体的定位提供了庇护所。因此,病原体与肿瘤之间互利的相互作用,即“病原体-肿瘤共生体”,很可能是肿瘤治疗的潜在治疗点。在此,我们提出了一种破坏病原体-肿瘤共生体的策略,即杀死瘤内病原体核酸酵母菌,打破共生体,协同杀死结直肠癌(CRC)细胞。 |
7月21日,来自同济大学的研究团队在《Signal Transduction and Targeted Therapy》上发表了名为“Destroying pathogen-tumor symbionts synergizing with catalytic therapy of colorectal cancer by biomimetic protein-supported single-atom nanozyme”的研究论文,研究为破坏病原体-肿瘤共生体以阻断瘤内病原体与 CRC 的相互作用从而进行抗肿瘤治疗提供了一个可行的范例,也为可清除蛋白支持的 SAN 催化治疗提供了一条优化途径。

https://www.nature.com/articles/s41392-023-01491-8
研究背景
细菌与癌症之间的密切关系已逐渐被人们深入认识。近年来,科学家们发现,细菌不仅存在于几乎所有肿瘤部位,也存在于免疫细胞中,而且微生物组的组成在不同癌症类型中存在显著差异。多项研究表明,肿瘤细胞从特定细菌中获得了巨大利益,包括逃避免疫识别和攻击、促进增殖、诱导远处转移和降低疗效等。病原体-肿瘤共生体的整体观可能在癌症治疗的发展中占据重要地位。
研究过程
在生物领域,铜在蛋白质组成和生物催化活化等自然生物过程中发挥着不可或缺的作用。20 铜基纳米材料可以逃脱离子泵的作用,使丰富的铜被内吞到细胞质中。单原子纳米酶(SANs)由于比表面积大、原子利用率高而具有很高的催化活性,在传感、降解、肿瘤抑制和抗菌等方面发挥着多功能作用。针对特定肿瘤微环境(TME)进行靶向催化治疗的 SANs 在癌症治疗中展现出广阔的前景,并为杀灭瘤内病原体提供了先决条件。目前可用的 SANs 主要基于碳基支持物,如掺杂 N 的碳和氮化碳。其他一些金属单原子掺杂在过渡金属氧化物等非碳基支持物上。蛋白质基材料通常具有生物相容性、生物可降解性和丰富的功能基团等优点,所有这些都有助于其在临床上的成功应用。因此,设计和开发以蛋白质为基础、以金属元素为活性中心、高度模拟天然酶结构的 SANs 有可能拓展人工酶的种类,并为合成高性能蛋白质基 SANs 提供范例。
我们提出了一种破坏病原体-肿瘤共生体的策略,即直接消灭瘤内病原体具核梭杆菌(F. nucleatum),从而打破共生体,协同杀死CRC细胞。这一策略是通过一种突破性的蛋白质支撑铜单原子纳米酶(BSA-Cu SAN)来实现的,BSA-Cu SAN通过催化H2O2产生活性氧(ROS),从而杀死瘤内的F. nucleatum,继而降低CRC细胞的自噬水平,增强ROS对细胞凋亡的氧化损伤,从而达到满意的治疗效果。所获得的 BSA-Cu SAN 可被动地靶向肿瘤部位,有效地将 H2O2 催化成有毒的 -OH,并同时消耗 TME 中的还原型谷胱甘肽(GSH),导致氧化还原失衡。作为一种臭名昭著的瘤内病原体,F. nucleatum 可被有效抑制,而作为一种正反馈,F. nucleatum 介导的ROS抗性可在 BSA-Cu SAN 的单一试剂下得到缓解,从而促进 CRC 细胞死亡。值得注意的是,蛋白基 BSA-Cu SAN 具有良好的生物相容性和肾脏清除能力,成功解决了掺杂 N 的碳基 SAN 的累积毒性问题。
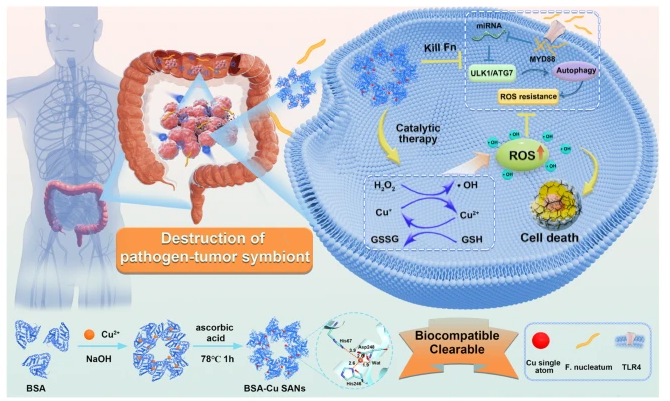
研究意义
这项研究通过破坏病原体-肿瘤共生体这一不常用的治疗靶点,为以病原体为中心的癌症治疗提供了一种前景广阔的方法,同时也为构建高仿生人工蛋白支持的单原子纳米酶,实现SAN催化治疗的临床转化过程提供了一种值得赞赏的尝试。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41392-023-01491-8
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发