【Nature子刊】重大进展!中山大学发现“癌中之王”胰腺癌转移的调控新机制
| 导读 | 导读:在过去的几十年里,胰腺导管腺癌(PDAC)患者的预后进展落后于许多其他恶性肿瘤的治疗进展。尽管SUMO通路在PDAC中的关键作用已经阐明,但潜在的分子驱动因素尚未完全清楚。 |
日前,中山大学殷晓煜、倪绪皓及赵蔚在知名期刊《Cell Death & Differentiation》上发表了题为“SUMO specific peptidase 3 halts pancreatic ductal adenocarcinoma metastasis via deSUMOylating DKC1”的研究论文,该研究表明SUMO特异性肽酶3通过去SUMO化DKC1阻止胰腺导管腺癌转移。

https://www.nature.com/articles/s41418-023-01175-4
研究背景
01
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)是最常见的胰腺癌,其5年总生存率(OS)较差(约为9%),成为癌症相关死亡的常见原因。手术切除仍是PDAC最有效的治疗方法。然而,由于局部进展或远处转移,确诊时只有20%的患者有手术机会。在过去的几十年里,尽管诊断方法、围手术期管理、放疗技术和全身治疗的进步丰富了PDAC治疗的武器库,但仅取得了适度的进展。因此,寻找提高PDAC患者生存率的有效途径势在必行。
翻译后修饰(PTMs),包括磷酸化、甲基化、泛素化和SUMO化,在调节蛋白质的成熟、降解、结构形成和亚细胞分布中发挥重要作用,从而丰富蛋白质功能和调控网络。在过去的几十年里,SUMO通路在介导肿瘤进展中的作用被广泛报道。在PDAC中,SUMO通路被报道与MYC过度激活和患者预后不良相关。此外,在PDAC中研究了一种新的靶向SEA的SUMO抑制剂的治疗潜力,结果表明抗肿瘤免疫是通过减弱SUMO途径引起的。然而,SUMO介导的促肿瘤作用的详细机制仍然知之甚少。
伪尿嘧啶合成酶(DKC1)基因最早在先天性角化不良症(DC)中被发现。近年来,许多研究表明,DKC1的失调与脑、肺、乳腺、肝、结肠等多种人类癌症患者的肿瘤生长转移及预后有关。
本研究中,研究人员通过体内转移模型筛选SUMO特异性蛋白酶,确定了SENP3是PDAC的转移抑制剂。此外,SENP3在PDAC组织中的表达降低,与患者预后良好相关。进一步研究发现,DKC1过表达可能会破坏SENP3的抗转移作用,高水平的DKC1预示PDAC患者预后较差。
研究过程
02
虽然SUMO通路在胰腺导管腺癌(PDAC)中的重要作用已在几篇文献中得到证实,但SUMO介导的调节的分子驱动因素仍未完全了解。研究人员进行了shRNA筛选,以确定可以调节PDAC转移的候选基因。为了进一步证实研究结果的临床重要性,研究人员使用在线GEPIA2数据集分析了每种特异性肽酶(SENP)对预后的影响,结果显示只有SENP3与PDAC患者的预后具有良好的相关性。进一步分析表明,这些有利的结果可能归因于SENP3表达较高的患者的基因突变(如KRAS和TP53)负担较低。
接下来,研究人员尝试确定SENP3蛋白在人类PDAC组织微阵列(TMA)中的表达,免疫组织化学(IHC)结果显示,与正常组织相比,PDAC标本中的SENP3蛋白表达下调。同样,研究人员也通过免疫印迹法测定了PDAC和配对的中心非肿瘤组织中的SENP3水平,发现PDAC中SENP3的表达明显降低。此外,与对照组相比,IHC评分较高的患者预后较好。综上所述,SENP3可能在PDAC患者中发挥保护作用。
为了揭示SENP3及其酶活性在PDAC进展中的作用,研究人员建立了稳定的野生型SENP3过表达(wt-oe) PDAC细胞。为了进一步确定SENP3在体内对PDAC的抗转移作用,研究人员将PDAC细胞(内源性表达空载体或野生型SENP3或突变型SENP3的Patu-8988t细胞)原位注射到裸鼠胰腺。研究发现,SENP3在体内和体外都能抑制PDAC转移,这取决于其在SUMO系统中的酶效。
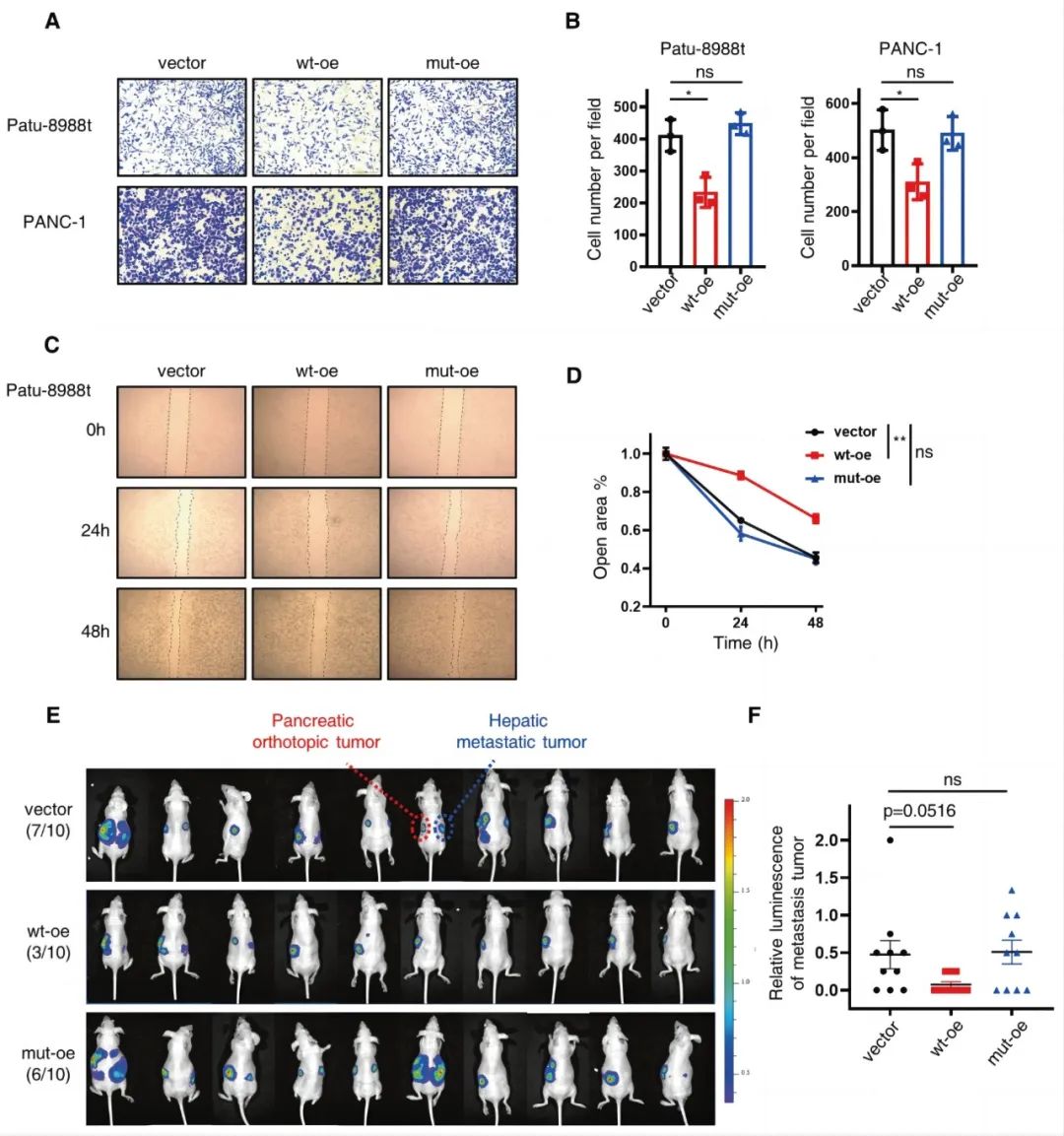
野生型SENP3抑制PDAC转移
当野生型SENP3在这些sh-DKC1细胞中过表达(S3-oe)时,这两种携带SENP3-oe的sh-DKC1细胞之间的转移没有显著差异,这意味着SENP3以依赖DKC1的方式对PDAC进行调节作用。
为了验证MS结果,研究人员转染了带有flag标记的SENP3和ha标记的DKC1结构。接下来,研究人员开始研究DKC1是否可以被SUMO化。研究人员还试图评估SENP3是否可以逆转DKC1的SUMO化。之后,研究人员试图确定DKC1中受SUMO化影响的潜在靶点。
与其他类型的翻译后修饰类似,SUMO化的结果是底物特异性的。为了证实SENP3的功能是通过降低DKC1的表达和消除snoRNP蛋白之间的相互作用来发挥的,研究人员在SENP3表达增加的细胞(S3-oe)中过表达野生型DKC1 (S3-oe+ D1 wt-oe)或SUMO化抗性DKC1 (S3-oe+ D1 mut-oe)。
为了更好地表征DKC1在PDAC中的作用,研究人员在上述组织微阵列中检测了DKC1的蛋白表达。研究结果意味着SUMO化的DKC1可能发挥更强大的促肿瘤作用。
研究意义
03
总之,本研究揭示了先前未发现的SENP3在PDAC中的作用。研究发现SENP3在PDAC组织中的表达水平明显降低,并与PDAC患者良好的预后相关。此外,在PDAC细胞系中,SENP3的过表达降低了体内和体外的侵袭能力,这取决于其催化活性。从机制上讲,SENP3与DKC1相互作用,并介导该蛋白在三个不同赖氨酸残基上的去SUMO化。
研究还证实,DKC1能够逆转SENP3的抗转移作用,并与PDAC患者较差的预后相关。有趣的是,在SENP3低表达的患者中,DKC1不同表达的患者预后无差异。因此,这些发现强调了SENP3/DKC1轴在PDAC进展中的关键作用。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41418-023-01175-4
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发