西湖大学施一公团队再发文!解析人源pre-tRNA 剪接机制,完善剪接体结构“地图”
| 导读 | 从前体-tRNA(pre-tRNA)中去除内含子在所有三个生命王国中都是必不可少的。在人类中,该过程由tRNA剪接核酸内切酶(TSEN)介导,该酶由四个亚基组成:TSEN2,TSEN15,TSEN34和TSEN54。 |
4月6日,西湖大学施一公团队在《Molecular Cell》发表题为“Structural basis of pre-tRNA intron removal by human tRNA splicing endonuclease”的研究论文,研究揭示了人tRNA剪接核酸内切酶去除tRNA前体内含子的结构基础。报道了人TSEN在催化前和催化后的平均分辨率分别为2.94和2.88 Å下与全长pre-tRNA结合的冷冻电镜结构。

https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00205-8#%20
研究概述
转运RNA (tRNA)对于遗传信息的流动至关重要,它允许核糖体将mRNA翻译成蛋白质。tRNA是生物遗传信息传递“中心法则”的重要参与者。作为蛋白质翻译过程的解码器,tRNA负责将mRNA中的遗传信息精确地对应到蛋白质序列中。在tRNA合成过程中,前体tRNA (precursor tRNA, pre-tRNA) 需要经过一系列转录后加工和修饰,才能生成成熟的tRNA。
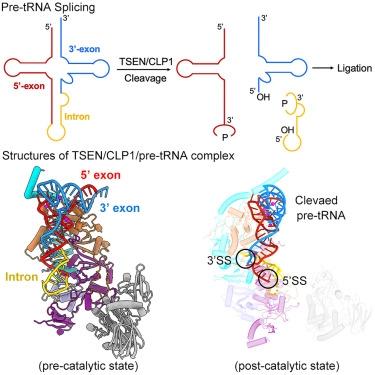
机理模式图
在该研究中,研究人员报告了人TSEN在催化前和催化后状态下与全长前tRNA结合的冷冻电镜结构,平均分辨率分别为2.94和2.88Å。人类TSEN的一个特征是具有扩展的表面凹槽,可容纳L形前tRNA。前tRNA的成熟结构域被TSEN34、TSEN54和TSEN2的保守结构元件识别。这种识别定向了前tRNA的反密码子干,并将3′剪接位点和5′剪接位点分别置于TSEN34和TSEN2的催化中心。大部分内含子序列与TSEN没有直接相互作用,这就解释了为什么可以容纳和切割不同内含子的前tRNA。总之,我们的结构揭示了TSEN切割前tRNA的分子标尺机制。
研究回顾
2023年2月17日,西湖大学施一公及张晓峰团队在《Nature Communications》发表题为“Mechanisms of the RNA helicases DDX42 and DDX46 in human U2 snRNP assembly”的研究论文,研究揭示了人U2 snRNP 组装中RNA解旋酶DDX42和DDX46的作用机制。
在该研究中,研究人员报道了DDX42-SF3b复合物的高分辨率结构和含有DDX42的17S U2 snRNP的假定组装中间体。同时,研究还分离出一种含有DHX15的U2 snRNP,但DHX15的位置没有被EM密度图识别出来。该研究结构揭示了SF3B1与DDX42、DDX46和pre-mRNA的多嘧啶束(PPT)相互作用的共同显著模式。结合结构引导的生化分析,该研究揭示了DDX42和DDX46在U2 snRNP组装中的作用,并为SF3B1癌症突变提供了见解。
2023年1月2日,西湖大学施一公团队在《Cell Research》发表题为“LilrB3 is a putative cell surface receptor of APOE4”的研究论文(并被选为当期封面文章),该研究首次报道发现了一个能够特异性结合APOE4蛋白,而几乎不和APOE2蛋白结合的免疫检查点受体蛋白LilrB3。这一发现打开了阿尔兹海默症患者的“记忆之门”,为我们理解阿尔兹海默症的发病机制,以及展开针对性的药物设计,迈出了突破性的一步(转化医学网360zhyx.com)。
参考资料:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00205-8#%20
https://mp.weixin.qq.com/s?
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发