【Gut】“三管齐下”!铁依赖性细胞死亡或为癌症新型联合疗法的关键
| 导读 | 十年前,一种新型的细胞程序性死亡方式:铁依赖细胞死亡(iron-dependent cell death),或“铁死亡”(ferroptosis)。与其他细胞凋亡方式不同,发生铁死亡的细胞会吸收更多铁元素;铁在细胞内参与代谢,最终损坏细胞膜。“铁死亡”参与了人体内的诸多控制机制——例如参与细胞的发育过程以及清除缺陷或衰败的细胞。 |
近些年来,免疫疗法已经成为对抗癌症的一种治疗选择:通过刺激人体自身的防御系统来杀伤癌细胞。一些免疫疗法已成功靶向了免疫体统中被称为“免疫检查点(immune checkpoint)”关键部位——这些关键部位调低了免疫系统的“威力”。
免疫检查点可被看作位于T细胞(一种抗癌免疫细胞)表面的“关闭开关(off switch)”——这些“开关”可以下调T细胞的活性。某些“关键”的蛋白质操控着这些开关;许多肿瘤会制造这样的“关键蛋白”,以保护自己不被T细胞攻击。这也解释了为什么通过一些包括免疫检查点抑制剂(ICIs)在内的药物来阻碍此“关闭开关”已成为当前某些癌症的标准治疗方法。不幸的是,某些癌症——例如肝癌——对于免疫检查点抑制的反应不大。
近日,来自德国Georg-Speyer-Haus生物医学研究所、德国法兰克福大学附属医院和法兰克福大学的研究者们在患有结直肠癌的小鼠模型中观测到了一种可以触发“铁死亡”并进而导致某类T细胞活性上调的物质。活性上调的这类T细胞被证实能系统性地消灭癌细胞。
其研究论文于1月27日发表于国际权威胃肠病和肝脏病学科期刊 Gut(IF:31.79)。
https://gut.bmj.com/content/early/2023/01/27/gutjnl-2022-327909
三管齐下,增强T细胞活性
问题来了——虽然研究者们发现了上述能够上调T细胞活性的物质,但仍存在两种相互独立的机制能够在短时间内再次下调T细胞活性:1.癌细胞形成一种“关键”蛋白(细胞程序性死亡-配体1,PD-L1),以此来打开下调T细胞活性的开关; 2.免疫系统的其他细胞——被称为“髓系抑制细胞(myeloid suppressor cells)”——也会赶到战斗现场,它们的任务也是削弱机体的免疫反应。
然而,当研究者对患病小鼠“三管齐下”时,小鼠肝部肿瘤的生长被显著地抑制了——该三重混合物(a triple combination)包括了:1.“铁死亡”激活剂;2.一种免疫检查点抑制剂;3.一种阻碍髓系抑制细胞到达“战斗现场”的物质。
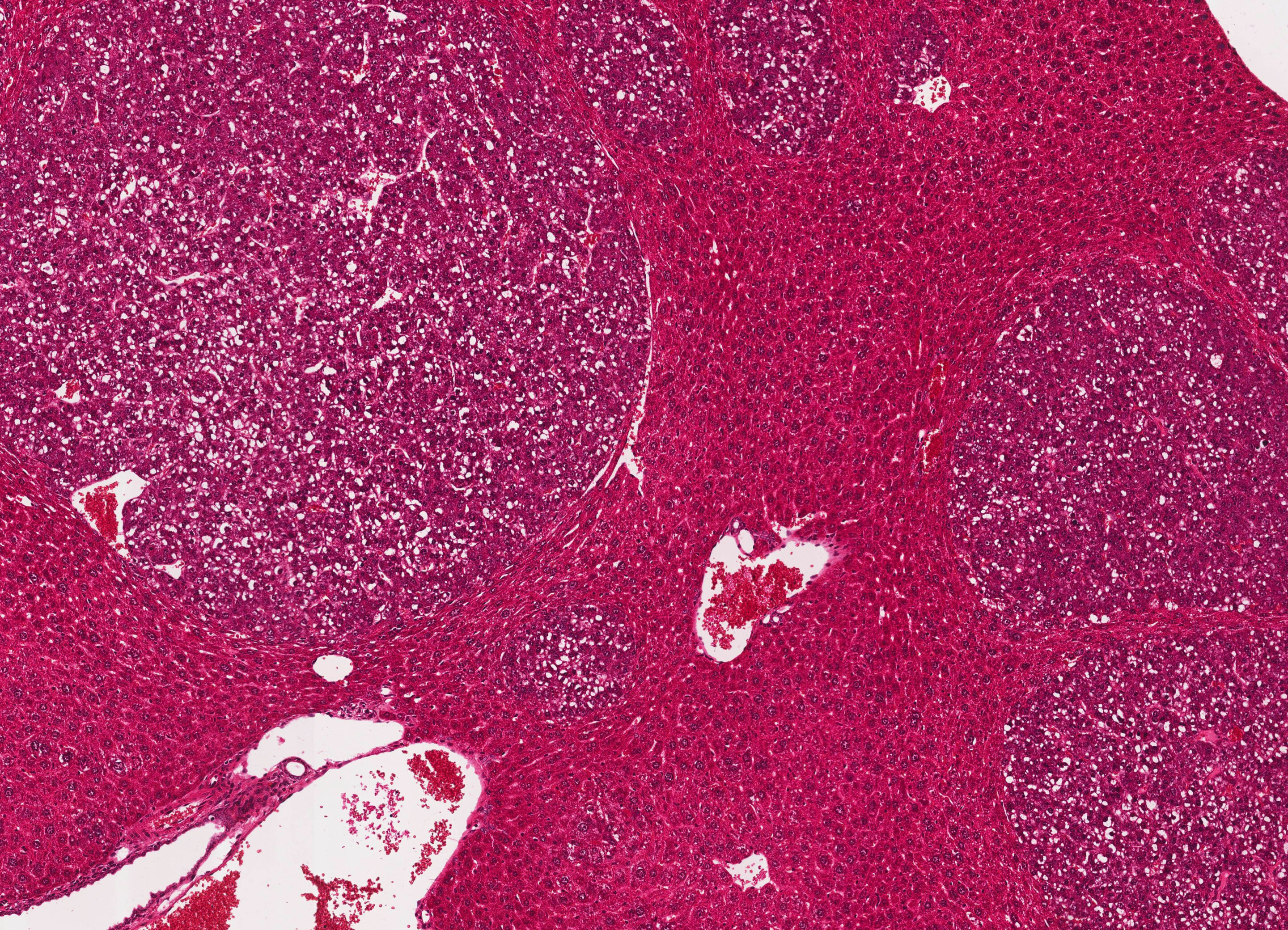
上图:光学显微镜图像显示了患病小鼠的肝脏,其中已形成了许多肿瘤;这些肿瘤颜色略深,呈圆形,并与健康组织形成分界。
图片来源:法兰克福大学附属医院
在对小鼠的进一步研究中,研究者们证实了上述“三管齐下”的联合疗法还能够减少由转移性结直肠肿瘤引发的肝转移瘤的数量。然而,值得注意的是,结直肠肿瘤本身对该联合治疗没有反应。
该研究的第一作者、Fabian Finkelmeier教授解释道:“显然,该联合治疗依赖于肝部的微环境,而非依赖于原发肿瘤——这意味着我们的联合治疗将有希望治疗任何类型肿瘤引发的肝转移瘤。”
该研究的另一位第一作者Claire Conche博士表示:“通过这种新型联合疗法,我们将能从三个方面对免疫系统进行支援:首先,我们使得抗肿瘤T细胞重新对癌细胞做出反应;然后我们帮助抗肿瘤T细胞清除了障碍——髓系抑制细胞和来自PD-L1的屏蔽。”
Georg-Speyer-Haus生物医学研究所主任Florian Greten教授表示:“这项研究强调了肿瘤微环境在癌症治疗中的关键作用。在此研究中,我们聚焦了肿瘤微环境的免疫区室(immune compartment),以及如何调节免疫系统,使其发生强抗肿瘤反应。此临床前模型中的数据为改善肝细胞癌和肝转移患者的免疫治疗选择提供了令人鼓舞的基础。”(转化医学网360zhyx.com)
参考资料:
https://medicalxpress.com/news/2023-02-liver-cancer-iron-dependent-cell-death.html
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发