【Cell子刊】浙江大学团队揭示了钾离子在肿瘤微环境中调控巨噬细胞免疫代谢的机制
| 导读 | 肿瘤微环境(TME)是一个独特的生态位,由所有肿瘤内细胞区室内和跨所有肿瘤内细胞区室的恒定串扰控制。重要的是,肿瘤内高钾对T细胞显示出免疫抑制作用。然而,作为与局部坏死相关的泛癌特征,这种离子紊乱对先天免疫的影响尚不清楚。一项新研究解释了肿瘤内高K+抑制肿瘤相关巨噬细胞(TAM)的抗肿瘤能力以及Kir2.1能够作为重塑TAM抗肿瘤能力的潜在靶点。 |
2022年9月13日,浙江大学王迪及丁克峰教授共同通讯在《Cell Metabolism》上在线发表了研究论文,研究揭示了肿瘤内高K+抑制肿瘤相关巨噬细胞(TAM)的抗肿瘤能力。研究人员将向内整流的高K+通道Kir2.1确定为高K+ TME中TAM功能极化的中枢调节剂,其有条件的耗尽会让TAM重新极化为抗肿瘤状态,以此依次增强局部抗肿瘤免疫力。

https://www.cell.com/cell-metabolism/fulltext/S1550-4131(22)00359-X#relatedArticles
TAM的双重功能
01
肿瘤相关巨噬细胞 (TAM) 在肿瘤内和肿瘤之间构成动态且异质的细胞群。这种异质性反映了TAM在肿瘤进展和结果方面的双重功能。TAM不仅可以消灭肿瘤并诱导抗肿瘤反应,还能促进肿瘤免疫逃逸和抑制免疫治疗。然而,营养缺乏的TME内的代谢适应极大地影响了 TAM的功能状态。同时,研究者对于细胞代谢程序与TME 内对外部营养物质的偏好之间的内在联系了解不多。研究人员认为:通过描述TAM如何适应TME的独特利基的基本机制可能为开发 TAM 靶向免疫疗法提供新的方向。
巨噬细胞条件性敲除
02
浙江大学团队利用多种小鼠肿瘤模型以及人临床肿瘤样本,发现肿瘤内高K+显示出对TAM抗肿瘤极化的抑制作用。进一步研究鉴定了内向整流K+通道Kir2.1作为TAM感知高K+TME并发生极化的重要调控分子。当条件性敲除Kir2.1能够解除高K+对TAM的抑制作用,使TAM复极化以重新获得抗肿瘤作用,降低肿瘤负荷。通过流式细胞仪和单细胞分析,研究人员系统地描绘了Kir2.1巨噬细胞条件性敲除可以全局性重塑TME中免疫细胞的抗肿瘤功能。
TAM抗肿瘤能力的潜在靶点
03
进一步研究表明,Kir2.1缺乏会干扰电化学依赖的谷氨酰胺摄取,导致 TAM 代谢从氧化磷酸化向糖酵解重编程。功能代谢分析揭示了Kir2.1在TAM的代谢偏好性中发挥重要作用,Kir2.1维持的巨噬细胞膜电势对于电化学依赖的谷氨酰胺转运体SNAT2的功能至关重要。
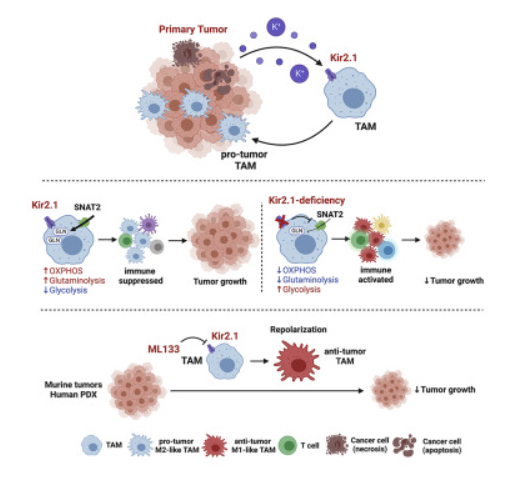
最后,研究人员通过使用Kir2.1的选择性抑制剂ML133来评估药理学靶向Kir2.1的治疗潜力,结果表明,ML133与PD-1单抗的联合利用显示出更好的治疗效果。并且,ML133在小鼠移植肿瘤和结直肠癌患者来源的类器官中均显示出重编程TAM的巨大潜力。
Kir2.1缺乏会扰乱电化学依赖性谷氨酰胺的摄取,从而导致TAM代谢从氧化磷酸化到糖酵解的重新编程。Kir2.1阻断可减弱小鼠肿瘤和患者来源的异种移植生长。
研究结果显示,在离子紊乱的肿瘤微环境中,Kir2.1通过代谢重编程调节TAM的极化,从而影响其免疫功能。因此,Kir2.1能够作为重塑TAM抗肿瘤能力的潜在靶点。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(22)00359-X#relatedArticles
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发