【研究】中科院钱文峰团队发现了“Omicron变种可能来自小鼠”的新证据!
| 导读 | COVID-19大流行已导致全球重大疾病和死亡。SARS-CoV-2 Omicron变体于2021年11月24日在南非首次报道,世界卫生组织在两天内将其指定为关注变体。Omicron的近端起源很快成为科学和公共卫生界激烈辩论的争议话题,导致关于其进化历史的三个普遍假设,第一个假设是Omicron可能已经“秘密传播”并在病毒监测和测序不足的人群中传播。其次,Omicron可能已经在慢性感染的COVID-19患者中进化。第三种可能性是Omicron可能在非人类宿主中积累了突变,然后跳入人类。目前,第二种情况代表了关于Omicron近端起源的最流行的假设。近日,中科院钱文峰团队揭示了一项新的证据,表明“Omicron变种可能来自小鼠”。 |
来自北京中国科学院的钱文峰团队最近报告了一项有趣的新证据,表明Omicron变种可能来自小鼠。他们的论文发表在BioRxiv预印本服务器上,并在几天后就被《Journal of Genetics and Genomics》迅速收录并发表,并且推翻了普遍的理论,即Omicron的多突变刺突序列一定是在一个严重的免疫缺陷患者的长期感染下进化的。

https://www.sciencedirect.com/science/article/pii/S1673852721003738?via%3Dihub
他们的主要想法是,小鼠可能通过“反向人畜共患病转移”以某种方式感染了人类病毒,随后该病毒进化出了它45个新突变中的全部或大部分,然后又转移回了人类。这个理论也许可以解释为什么Omicron在系统发育树中显得如此异常,但还有一个主要的问题:人类ACE2受体(hACE2)的小鼠同源物,病毒通常利用该受体进入细胞,对标准的SARS-CoV-2刺突蛋白几乎没有亲和力。

为了在这种首选的研究动物身上研究这种病毒,科学家必须人工引入hACE2,以创造出在感染时表现出任何显著呼吸窘迫的小鼠。这些转基因小鼠是通过几种方式制备的,每一种都表现出独特的组织趋向性、外显性和相应不同的效应。研究人员进行了敲入实验,将人类hACE2序列整合到宿主基因组中,并在若干不同启动子的控制下诱导。腺病毒也可以用来感染细胞,并产生繁殖hACE2编码的复制质粒。
考虑到这些问题,标准的人类病毒是如何在小鼠身上扎根的呢?关于Omicron序列和疾病后遗症与其他四种变体的不同,有几件事是显而易见的。虽然Omicron似乎更具传染性,但它似乎也不那么严重——它似乎不会以同样的方式针对深层肺中的不同细胞类别。这些细胞类型可能包括细支气管和肺泡上皮细胞,肺泡巨噬细胞,和各种指定的肺细胞。一种可能的解释是,Omicron并不依赖于ACE2的接收和随后的TMPRSS裂解来感染。相反,它似乎更倾向于组织蛋白酶的直接内体摄取和切割。
研究人员推断,如果Omicron确实在小鼠中进化,那么它在小鼠体内获得的45个突变的详细细节应该直接反映出这一点。换句话说,由于每种生物具有不同的DNA修复机制,核苷酸丰度,密码子偏好,氧化背景和其他突变倾向,因此其突变的“分子谱”应揭示物种特异性特征。实际上,这是一个艰巨的任务。尽管如此,研究人员利用Omicron从其最近的祖先B.1.1.529进化过程中12个可能的碱基对替换(即A>C,T,或G, C>A,T,或G等)追溯病毒宿主。
他们发现,Omicron的分子突变谱与在人类患者身上进化的所有其他病毒的分子突变谱明显不同,但与在小鼠细胞中与病毒进化相关的分子突变谱非常相似。虽然最近也有人提出,Omicron可能是在小鼠甚至是鹿等中间宿主的短暂入侵后产生的,但这项研究是“首次在这种人畜共患病两步法的骨头上放上真正的肉”。研究人员认为,观察到的突变,以及插入和删除,可能与小鼠大约一年的进化过程相一致。然而,像这样估计突变滞后时间是出了名的困难,而且常常有点主观。
进一步对在不同宿主物种中进化的冠状病毒的分子谱进行了表征,并与Omicron的分子谱进行了比较。具体来说,检索了17个小鼠肝炎病毒序列、13个犬冠状病毒序列、54个猫冠状病毒序列、23个牛冠状病毒序列和110个猪三角型冠状病毒序列。
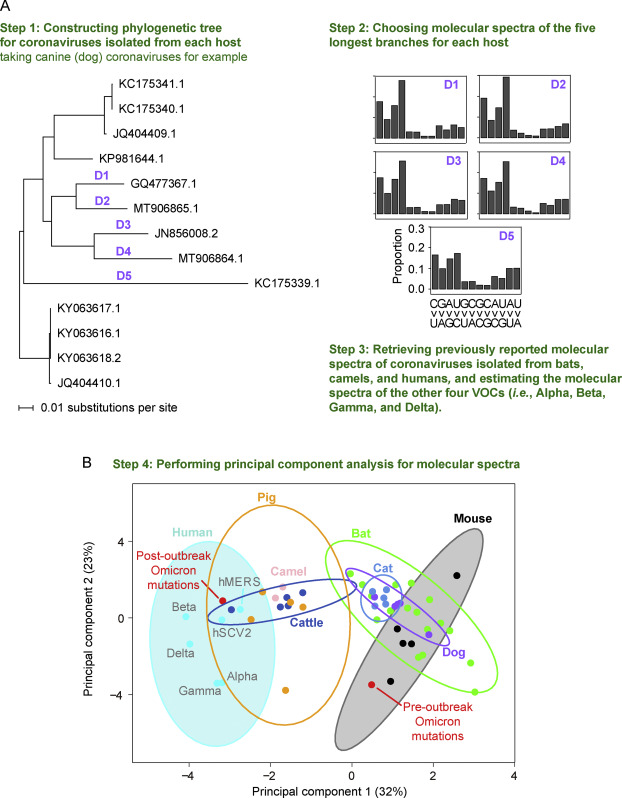
爆发后Omicron突变(已知在人类中积累)的分子谱位于人类的95%置信椭圆区间内。相反,爆发前Omicron突变的分子谱在小鼠椭圆内,表明爆发前突变在啮齿动物(特别是小鼠)宿主中积累
这些突变中的一些,以及它们提供的相关病毒装备是相当奇怪的。例如,仍然无法解释在SARS-CoV-2中插入一个furin蛋白酶切割位点,在Omicron中获得了一个额外的关键精氨酸,这一修饰似乎进一步增强了病毒生命周期中furin的处理。然而,现在一系列新的研究表明,从稀薄的空气中进化出furin蛋白酶切割位点可能不像以前想象的那样大。在这一点上,欧洲蝙蝠被证明具有冠状病毒,该冠状病毒与S1/S2刺突位置处的多碱基furin切割位点相距仅一个突变。Omicron的其他特征包括逃避疫苗和抗体治疗,但不包括T细胞反应。另一方面,在Omicron中未观察到由猖獗的细胞融合形成的合胞体,这可能可以解释为什么它不那么严重。
如果Omicron确实切换到小鼠,那么它是什么样的小鼠?也就是说,它是野生小鼠还是实验室小鼠?如果是后者,则是整个小鼠还是仅来自小鼠的细胞?早在2007年,研究人员就表明,他们可以完全改造人类SARS-CoV-1,使其感染小鼠,病毒在动物体内连续传播15次后造成呼吸道破坏。Ralph Baric等人最近对SARS-CoV-2只用了10段就做到了这一点。这些操作显然加速了在自然环境中可能发生的几倍的进化。这正是为什么要这样做的原因。在细胞培养中,事情可以做得更快。上述在Omicron中研究的同样种类的具有说明作用的分子突变谱在特定细胞系中传代后也可能很明显。换句话说,根据所用特定细胞系的需要和倾向,病毒的特征可以在特定的培养条件下容易地进化。
例如,Calu-3细胞(人肺腺癌上皮细胞)的Delta变异感染比Omicron感染高4倍,这种细胞具有高表达的TMPRSS并倾向于细胞表面感染途径。另一方面,在HEK细胞(人类胚胎肾细胞)中,最适合进入核内体,Omicron感染比delta高10倍。当有可能混合表达不同物种受体的转基因细胞系被扔进混合物中时,很难知道会发生什么。(转化医学网360zhyx.com)
参考资料:
https://medicalxpress.com/news/2022-01-omicron-mouse-kind.html
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发