Science :新冠病毒研究新突破,疫苗研究也可按图索骥
| 导读 | 新冠病毒攻坚战已进入白热化阶段,对抗传染病开发对应的疫苗可以帮助没有感染病毒的健康人预防感染,而目前针对新冠病毒的疫苗开发也正在开展中,然而根据过去的经验,病毒在感染过程中的三维结构可能会发生改变,这给疫苗开发带来了重重阻碍,想要加速疫苗开发过程,就需要研究者们从根本入手,按图索骥,但是图从何来?近日德克萨斯大学的研究人员给出了答案。 |
导语:新冠病毒攻坚战已进入白热化阶段,对抗传染病开发对应的疫苗可以帮助没有感染病毒的健康人预防感染,而目前针对新冠病毒的疫苗开发也正在开展中,然而根据过去的经验,病毒在感染过程中的三维结构可能会发生改变,这给疫苗开发带来了重重阻碍,想要加速疫苗开发过程,就需要研究者们从根本入手,按图索骥,但是图从何来?近日德克萨斯大学的研究人员给出了答案。

19日,来自德克萨斯大学奥斯汀分校和美国国立卫生研究院的研究人员于Science上发表了其创建的第一张病毒附着和感染人类细胞的三维原子尺度图,这将有助于开发2019年新型冠状病毒疫苗。
之前的研究已经证实2019-nCov感染人类细胞是通过ACE2受体,而与ACE2受体结合的部位便是刺突蛋白(spike protein)。该研究通过对实验室细胞中获取的2019-nCov预融合刺突蛋白进行纯化,再利用冷冻电镜得到了其在3.5埃下的高清结果图。该蛋白为一种高度糖基化的同源三聚体,在病毒融合过程中会经历构象变化。而刺突蛋白又可以分为两个功能单位:S1以及S2亚基。当S1亚基结合到宿主细胞受体上时,刺突蛋白三聚体的稳定性将会被破坏,造成S1亚基脱落,S2亚基形成稳定的融合后结构。
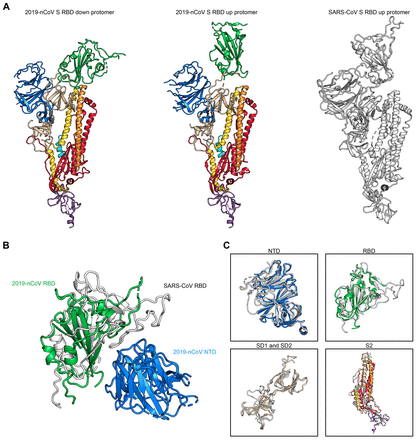
而正是S1亚基的C端受体结合区域(receptor-binding domain,RBD)负责刺突蛋白与ACE2受体的结合,为了与宿主细胞受体接合,RBD通过铰链状构象运动来隐藏或暴露受体结合位点的关键因素。作者将其分别命名为“下”构象以及“上”构象,其中“上”构象对应受体可结合状态,较为不稳定,而这为疫苗设计提供了重要位点。
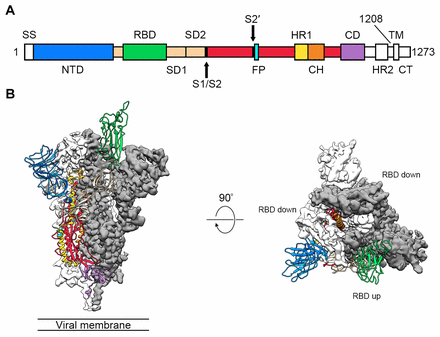
根据之前石正丽团队的研究结果2019-nCov与蝙蝠冠状病毒RaTG13在S蛋白序列上有98%的相似性。而突变位点发生在S1/S2亚基的连接处,而这其中29个残基突变中17个出现在RBD区域,通过与现有的刺突蛋白数据库比对,作者只发现了9种已知的氨基酸突变,并且这些突变都非常保守对于改变刺突蛋白结构作用有限。
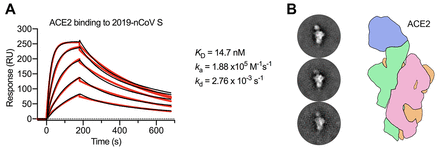
同时作者也通过SPR试验比较了SARS-Cov和2019-nCov刺突蛋白对ACE2受体的亲和力,结果显示相较于SARS-Cov,2019-nCov对ACE2的亲和力高达10-20倍,这有助于解释其发生高度人传人的原因。
针对S1亚基铰链式运动与SARS-Cov的相似性以及其与SARS-Cov的同源性,该课题组的研究人员测试了目前已发表的三种针对SARS-Cov RBD区域的多克隆抗体,结果发现这三种抗体对新冠病毒无效。这说明设计新冠病毒抗体可能需要针对其特异性部分重新研究。
而该课题组公布的冷冻电镜图将大大有助于未来研究者针对其刺突蛋白结构设计对应的化学探针,从而从康复者的血液中分离特异性抗体,大量的这些抗体有助于治疗初期的冠状病毒感染。这些抗体可以保护被送往感染率高的地区的医护人员,帮助他们渡过新冠病毒出现初期没有对应疫苗的窘境。
1.https://science.sciencemag.org/content/early/2020/02/19/science.abb2507/tab-figures-data
2.https://medicalxpress.com/news/2020-02-breakthrough-coronavirus-results-vaccine.html
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发