【Nature】中国研究者找到了这个“年轻疾病”的幕后真凶
| 导读 | 复旦大学附属医院去年接收一位小患者,无明显感染却反复发烧,几乎以医院为家的境况令人扼腕。 |
自身炎症性疾病是由先天性免疫系统的异常激活导致的罕见疾病,从出生一直维持到整个成年期,表现为每周或每月周期性高烧,并伴有淋巴结肿大。复旦大学附属医院去年接收一位小患者,无明显感染却反复发烧,几乎以医院为家的境况令人扼腕。
浙江大学生命科学研究院的周青研究员与哈佛大学医学院袁均英教授、复旦大学附属儿科医院王晓川携手攻关,发现人类受体相互作用蛋白RIPK1基因的Caspase8 切割位点显性遗传突变,是导致自身炎症性疾病的幕后真凶,并据此为患者设计新的治疗方案,取得显著的临床效果。这些重磅结果12月11日发表在《Nature》上。

RIPK1(receptor-interacting serine/threonine-protein kinase) 是先天性免疫信号通路的关键调节因子,激活肿瘤坏死因子TNF介导的细胞凋亡和程序性坏死等关键炎症途径。Caspase-8 作用于RIPK1激酶结构域中D324和D325位点,正确切割后,将功能结构域与中间结构域以及死亡结构域分离。先前研究表明,小鼠RIPK1基因中D325A位点突变后胚胎致死。
首先,研究者发现两位典型患者,来自中国的两岁男孩以及加拿大的35岁女性,自幼在无任何炎症的情况下患有周期性高烧、淋巴结肿大和肝脾肿大,并且35岁女性的症状同样表现在她四位后代中的3位身上。通过全外显子测序,发现两名患者RIPK1蛋白D324 Caspase8切割位点均发生突变。
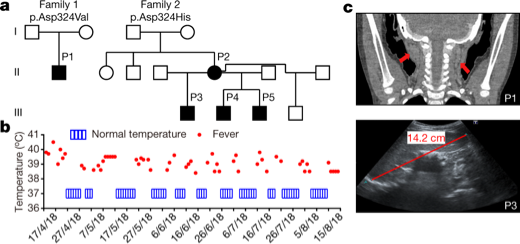
RIPK1切割位点杂合突变导致人体自身炎症
接着,研究者在患者血清中检测到促炎细胞因子和趋化因子IL-6,TNF以及IFNγ以及抗炎细胞因子IL-10含量显著上调。在发烧期间,炎症反应通路的激活更加显著,患者单核细胞中的IL-6下游STAT-6蛋白磷酸化显著上调。为进一步研究未被切割的RIPK1相关的蛋白表达变化,研究者患者外周血单核细胞(PBMC)中进行单细胞RNA测序,观察到NF-κB和I型IFN途径的强信号,促炎性细胞因子和趋化因子,包括IL8,IL1B和CCL3的高表达,RIPK3和MLKL等细胞坏死途径相关蛋白高表达。
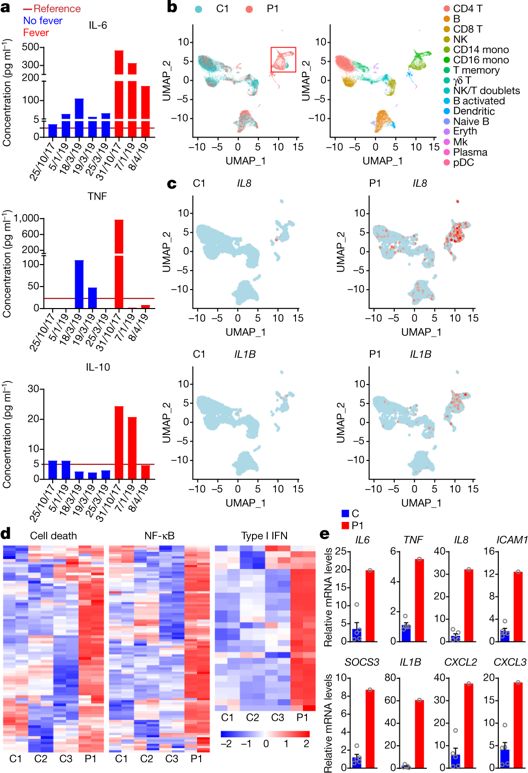
患者炎症信号通路显著激活
那么,RIPK1是如何介导异常激活的炎症通路呢?研究者使用CellTiter-Glo和ToxLight分析PMBC细胞存活状况,发现RIPK1突变患者对TNF诱导的细胞坏死和程序性凋亡更加敏感,而RIPK1激酶抑制剂能够逆转这种情况。并且,研究者于RIPK1突变患者尿液中检测到细胞坏死标志物亲环素A。以上结果表明,RIPK1的切割受阻导致激酶活性增加,提高患者PBMC对细胞坏死和凋亡的敏感性。
TNF诱导RIPK1突变患者PBMCs和MEF中炎症通路激活
进一步,研究者构建Pipk1敲除的小鼠胚胎成纤维细胞(MEF),在其中过表达野生型RIPK1和突变后RIPK1,发现前者对TNF诱导细胞死亡的敏感性较野生型更高,与在患者PMSC中的结果一致。在构建的Pipk1 D325A(对应人类D324)突变小鼠MEF中重复得到类似的结果。因此,模型小鼠未被切割PIPK1导致的RIPK1激活导致的凋亡,是不依赖于细胞坏死的独立通路。研究者基于RIPK1激活后病人体内炎症因子IL-6高表达的现象,提出给予tocilizumab IL-6受体抑制剂的治疗策略,阻断IL-6诱发的下游炎症通路。经过几个月治疗,患者周期性发烧的症状得到明显缓解,并且PBMS中相关炎症因子表达量逐渐恢复正常。
另外,研究者们意外发现,患者皮肤成纤维细胞能够抵御不同种类的细胞坏死,表现为RIPK1、TNFR1等蛋白表达水平明显下降,还原性谷胱甘肽含量升高以及ROS水平下降,提示患者体内产生多种应对RIPK1激酶活性上调的代偿机制,以维持体内稳态。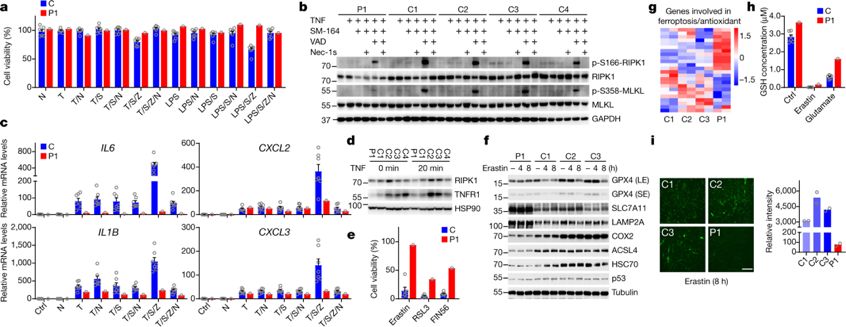
患者成纤维细胞抑制细胞坏死
值得一提的是,Nature上同时发表了来自澳大利亚的John Slike课题组的结果,揭示RIPK1 Capaese-8切割位点突变在胚胎发育和炎症维持中的重要作用。周青课题组的研究将异常周期性发热的自身炎症性疾病根源,定位到RIPK1 的Caspase-8切割位点异常,激酶活性上调导致的细胞凋亡和坏死敏感导致炎症通路的激活,为临床治疗提出了有效合理的策略。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发