胰腺癌新靶点出现!有望直击癌症干细胞,了断后顾之忧
| 导读 | 胰腺癌是恶性程度极高的消化道肿瘤,发病率逐年上升,已成为危害人类健康的重大公共卫生问题。胰腺癌具有复杂的解剖及病理特点,手术切除率低且术后容易复发和转移,对放化疗均不敏感,相关治疗效果皆难尽如人意。 |
胰腺癌是恶性程度极高的消化道肿瘤,发病率逐年上升,已成为危害人类健康的重大公共卫生问题。胰腺癌具有复杂的解剖及病理特点,手术切除率低且术后容易复发和转移,对放化疗均不敏感,相关治疗效果皆难尽如人意。我们多认为癌症干细胞(CSCs)对“癌王”穷凶极恶的表现功不可没,但目前相关靶点仍扑朔迷离。
近日,英国克里克大学的研究人员深入分析了胰腺癌的CSCs群,确定其表面广泛表达一种可以促进胰腺癌生长发展的蛋白质——CD9,表明其不仅可以作为识别CSCs的重要标志物,还有望成为胰腺癌精准治疗的潜在靶点。

CSCs——胰腺癌发生发展的“星星之火”
CSCs是很多癌症复发和转移的根源,因其自我更新和治疗抵抗等特性被认为是癌症发生、发展、耐药和复发的根本原因。CSCs是肿瘤组织中的一小群具有无限自我更新能力、多向分化潜能的特殊细胞群体,可形成肿瘤并维持肿瘤的生长,而且对常规的放化疗皆不敏感,使得其成为了传统“大扫荡”后的“幸存者”,其后春风吹又生,可在治疗间期快速成瘤,而新瘤对放化疗均有了抗性,使得传统治疗再无用武之地。
目前已在胰腺癌中分离出了相应的CSCs。有研究指出,胰腺癌CSCs具有不同表型,绝大多数皆具有自我更新能力,可通过分裂产生与亲代相同的未分化细胞并保持干细胞数量稳定。同时,胰腺癌CSCs也可以分化为较成熟的胰腺癌细胞。胰腺癌CSCs仅占肿瘤细胞总数的0.2%-0.8%,其致瘤性却是一般胰腺癌细胞100倍,仅100个CSCs细胞就可在胰腺原位形成肿瘤。也就是说,若不能完全清除CSCs,就难以避免其以燎原之势让肿瘤“复活”并更加肆无忌惮。而想要消灭CSCs,就得先让CSCs现形。
CD9——让胰腺癌CSCs无所遁形
CSCs与非CSCs在形态学上没有差异,因此难以根据细胞形态学的特点对其进行鉴定,所以,想让CSCs现形,就得找到CSCs特有的表面标记。研究人员发现,在胰腺癌发展的各个时期中,CSCs均高表达CD9。CD9是四跨膜蛋白超家族(TM4SF)的成员之一,在多种类型的细胞表面广泛表达,是影响胰腺癌细胞侵袭、分化能力的一种相关蛋白。结果显示,在胰腺癌组织中,CSCs与非CSCs的表面CD9的表达具有显著差异性,而且CSCs越活跃,这种差异就越分明。因此,CD9可作为识别CSCs的重要生物标志物,是让CSCs无所遁形的绝佳“现形剂”。
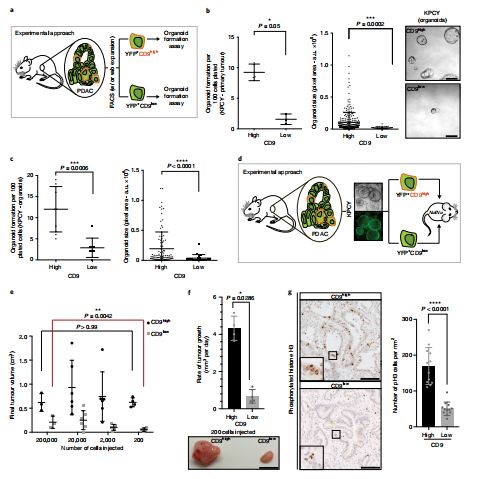
CD9在CSCs表面显著表达
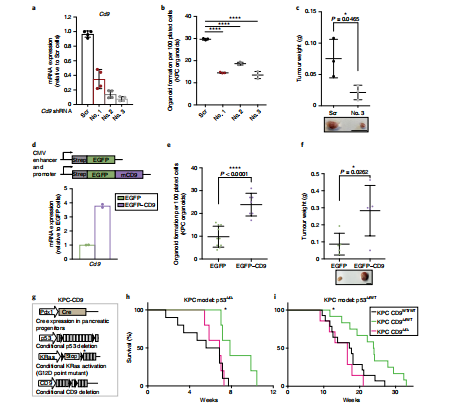
CD9与胰腺癌发展成正相关
另一方面,研究人员还发现CD9不仅仅是标志物,其还可以促进肿瘤的进一步发展恶化。他们改变了小鼠胰腺癌细胞中CD9的含量,发现CD9含量与肿瘤的发展成正比,即当CD9含量降低时,肿瘤会相应缩小,一旦CD9含量上升,癌种就会快速发展并更具侵袭性,预后也更加糟糕。他们指出,这是因为CD9可增加肿瘤细胞对谷氨酰胺的摄取率,而谷氨酰胺正是肿瘤细胞重要的能量来源。这也意味着CD9不仅可以让CSCs现形,还可作为靶向药物治疗的重要靶点,而直接靶向CSCs,或许会是了断胰腺癌治疗后顾之忧的关键之举。
这项研究突破了传统局限于肿瘤细胞的治疗方式,靶向新靶点CD9有望对CSCs釜底抽薪,切断肿瘤细胞能量来源,为胰腺癌的根治提供新的思路与希望。但目前仍需要更多实验进一步证明CD9对胰腺癌的作用,CD9非特异性表达的问题也需要时间解决。挑战仍多,我们静待佳音。(转化医学网360zhyx.com)
参考文献:
Victoria M.-Y. Wang,et al.CD9 identifies pancreatic cancer stem cells and modulates glutamine metabolism to fuel tumour growth.Nature Cell Biology volume 21, pages1425–1435(2019).
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发