《PNAS》重磅:发现治疗阿尔茨海默病的新靶点!
| 导读 | 阿尔茨海默病(AD)是一种起病隐匿的神经系统退行性疾病,截至2019年,我国共有1000多万AD患者,约占全球AD患者总数的五分之一,而且我国AD患者的平均存活年限仅有5.9年。这种疾病至今仍无法治愈,其发病机制也尚不明确。 |

阿尔茨海默病(AD)是一种起病隐匿的神经系统退行性疾病,截至2019年,我国共有1000多万AD患者,约占全球AD患者总数的五分之一,而且我国AD患者的平均存活年限仅有5.9年。这种疾病至今仍无法治愈,其发病机制也尚不明确。
近日,加州大学的研究人员在《PNAS》期刊上发表最新研究,他们发现了一种名为TOM-1蛋白质在AD致病中的重要作用,这也预示着阿尔茨海默病的治疗研究将有新的方向和靶点。

阿尔茨海默病是老年痴呆最常见的病症类型,我国是现今全球范围内AD患者最多的国家,从1997年开始,阿尔茨海默病的发病人数和死亡率都在持续翻倍增长,预计到2050年,全球阿尔茨海默病患者总数将达1.5亿。阿尔茨海默病也逐渐成为近十年来中国人的第五大死因更可怕的是,这种疾病的致病机理迄今未知,只能暂时改善和延缓。
尽管这种疾病正在严重威胁公共社会健康,但是阿尔茨海默病的药物研发依旧处于低谷。过去几十年中,基于学术界公认的“β淀粉样蛋白假说”,各大制药巨头企图研发出可以治疗阿尔茨海默病的药物,却无一成功,几乎所有的大型临床试验也都收效甚微。由此,科学界对“β淀粉样蛋白假说”的质疑声越来越高,阿尔茨海默病的真正病因仍悬而未决。
近几年,有研究证实,炎症是阿尔茨海默病的主要诱因之一,但炎症反应是复杂的,涉及多种潜在因素,如微生物感染等。
近日,加州大学记忆障碍和神经障碍研究所的研究人员在《PNAS》上发表了一篇关于治疗阿尔茨海默病的新方法的突破性进展,为炎症反应和AD密切相关再添实证。
研究证明,Interleukin-1β(IL-1β)介导的细胞反应会导致阿尔茨海默病。这种细胞因子与它的受体主要在大脑海马区表达,表达后和受体结合,引起炎症反应。在老年痴呆症患者的大脑中,研究人员发现虽然Tollip蛋白的表达水平保持稳态不变,但随着Myb1(TOM-1)蛋白质的表达水平出现显著降低,IL-1β的表达量持续增加,炎症反应加剧;在小鼠模型中,这种现象也同样存在。更有趣的是,TOM-1蛋白恰好在一种炎症反应中发挥着关键作用。
为了进一步搞清楚TOM-1和IL-1β在AD致病机制中的具体作用。研究人员分别下调和上调了TOM-1蛋白的表达量。结果证明,在小鼠模型中,当TOM-1蛋白水平明显降低后,小神经胶质细胞的吞噬效率会受到影响,体内的免疫炎症反应随之加剧,此时大脑中的淀粉样蛋白也明显增加,小鼠开始出现记忆损失和认知能力障碍等典型老年痴呆症状。而TOM-1蛋白质的水平明显增加时,表达效果非常类似于治疗作用,小鼠体内的炎症反应和记忆缺失等症状都得到相应缓解,甚至是逆转,个体认知水平能够恢复到类似于正常小鼠的水平。
这些数据表明,对TOM-1信号通路的修复或许正是治疗阿尔茨海默病等脑部炎症性疾病的重要靶点。而且,通过过表达TOM-1,进而控制β-淀粉样蛋白的沉积与体内炎症反应程度,将有望重塑AD疾病小鼠的认知能力。
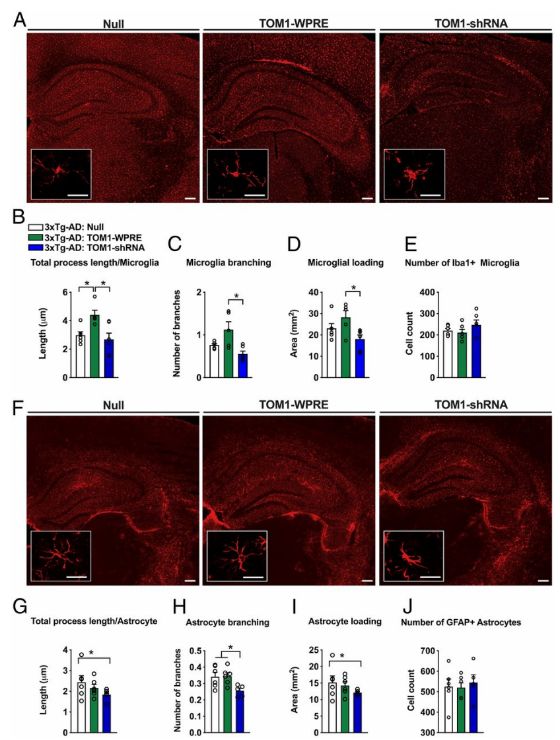
TOM1表达水平降低,会改变神经胶质的形态
如果将TOM-1蛋白假设为汽车的刹车,那么在老年痴呆症患者的大脑中,这个刹车已经完全失灵了。这篇研究就是在分子水平上重新修复刹车,以提供一个全新的治疗途径和策略。
这项研究也强调了在阿尔茨海默病的发病机制中,细胞核内体与炎症受体相互作用的重要性。有助于我们更好地了解了年龄增长时,人体内免疫系统的变化状态,从而设计出有效控制炎症反应,缓解和治愈阿尔茨海默病患的真正治疗方法。
参考文献:
Alessandra Cadete Martini, et al. Alessandra Cadete Martini et al. Amyloid-beta impairs TOM1-mediated IL-1R1 signaling, Proceedings of the National Academy of Sciences. September 30, 2019. DOI: 10.1073/pnas.1914088116

(转化医学网360zhyx.com)
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发