成也萧何败萧何——肿瘤免疫疗法成败皆系于钾离子
| 导读 | 近年来,肿瘤免疫治疗的好消息不断,PD-1/PD-L1疗法和CAR-T疗法的出现为癌症的治疗模式带来了革命性的变革,俨然成为当前肿瘤治疗领域的热点。但是,目前免疫治疗对晚期肿瘤的效果基本只有25%-30%左右,于其他患者而言不过是纸上谈兵,这是为什么呢? |
近年来,肿瘤免疫治疗的好消息不断,PD-1/PD-L1疗法和CAR-T疗法的出现为癌症的治疗模式带来了革命性的变革,俨然成为当前肿瘤治疗领域的热点。但是,目前免疫治疗对晚期肿瘤的效果基本只有25%-30%左右,于其他患者而言不过是纸上谈兵,这是为什么呢?

近日,美国国立卫生研究院(NIH)和美国国立癌症研究所(NCI)的研究人员指出,肿瘤微环境(TME)中高浓度的钾离子(K+)正是让免疫治疗中被激活的免疫细胞对肿瘤肆虐袖手旁观的元凶!更有意思的是,他们指出K+同时还可以恢复T细胞的干性!将之应用于过继性T细胞治疗疗效非常可观!也就是说,K+对肿瘤免疫治疗来说是把双刃剑!
--双刃剑之害—让激活的T细胞对肿瘤“隔岸观火”--
有研究指出,肿瘤细胞在死亡后会将K+释放到胞外空间中,而正常情况下,K+只在胞内高浓度存在,因此有科学家认为TME中不断堆积的K+可以降低T细胞的活性,阻止其抗肿瘤功能,但具体机制尚未完全明了。此次,NIH和NCI的研究人员对这一猜想做出了科学解释。
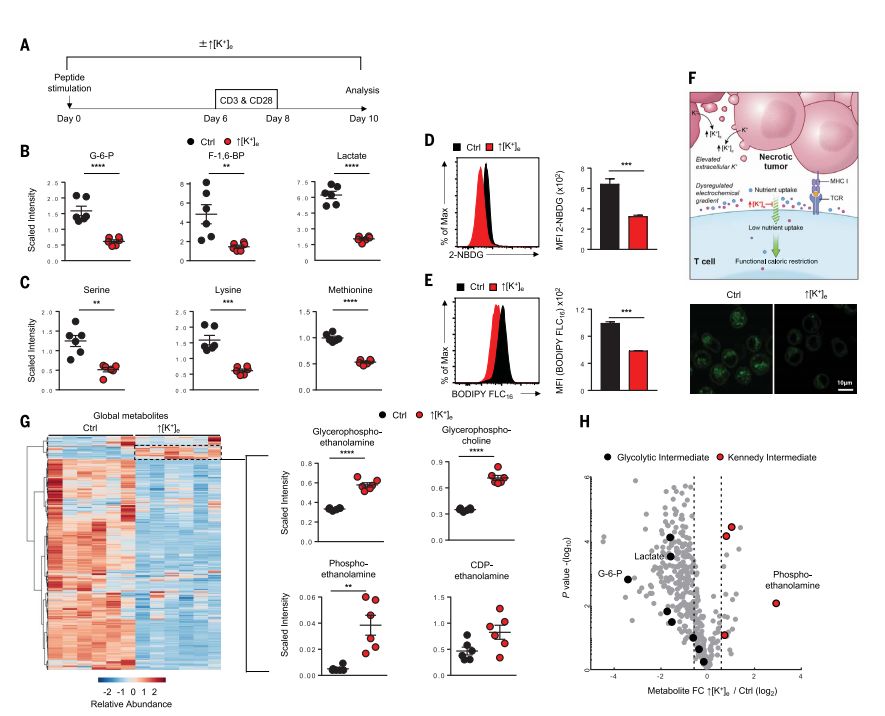
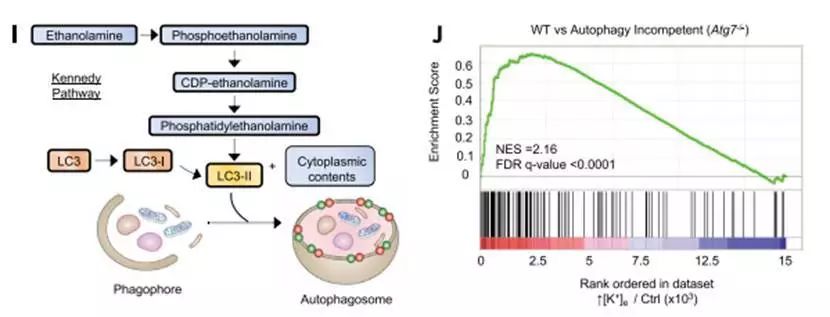
TME中高浓度K+触发T细胞营养摄取限制和功能性能量限制
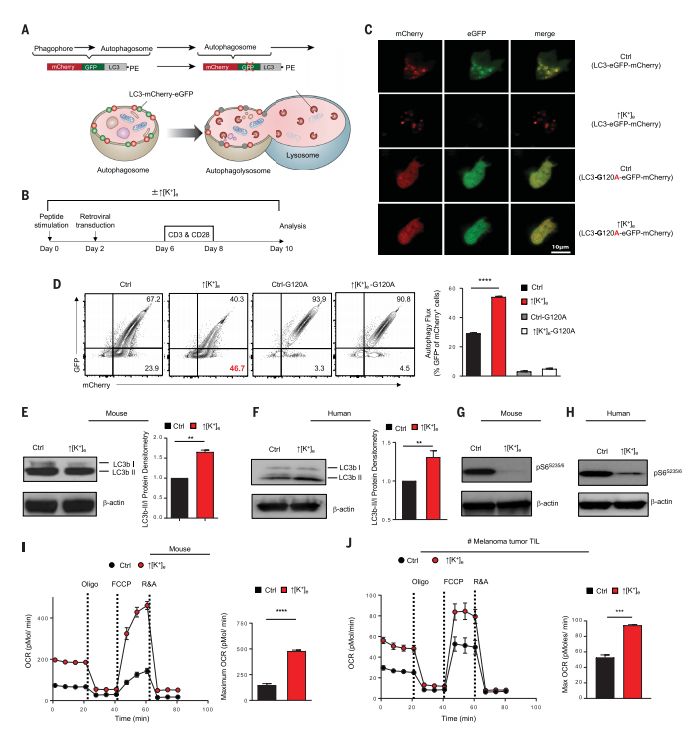
长期“面黄肌瘦”的T细胞更加容易发生自噬
通过对常规免疫治疗失败的肿瘤的实验分析,研究人员发现,TME中不断堆积的K+会严重影响T细胞的代谢,触发其营养摄取限制和功能性能量限制,导致T细胞难以从外界环境中摄取营养素,相当于剪除了T细胞的动力输送机制。T细胞没有足够的营养摄入,自然只能对肿瘤心有余而力不足了。而且,长期“面黄肌瘦”的T细胞更加容易发生自噬,进而将胞内的K+释放到TME中,进一步增加了TME中K+浓度,这就形成了恶性循环,再多的T细胞也不过是让肿瘤进一步恶化的帮凶罢了。所以,对肿瘤免疫治疗失败的患者而言,最重要的不是如何将免疫系统功能发挥到极致,反倒是要考虑如何降低TME中的K+浓度了,毕竟只有“喂饱”了T细胞,“健康卫士”才有力气奋勇杀敌啊。
--双刃剑之利——恢复T细胞干性--
另一方面,研究人员还发现在具有高浓度K+的TME中,T细胞的表观遗传修饰竟然也发生了变化!高浓度K+让T细胞恢复了干性!这种状态下的T细胞只能不断自我复制,却无法分化成效应T细胞,也就是说T细胞“返老还童”了!这有什么好处呢?高浓度K+相当于给T细胞的分化设下了禁制,导致具有干性的T细胞除了极强的自我复制能力外,还有强大的分化潜能,一旦这种禁制解除,其杀伤力是非常可观的。
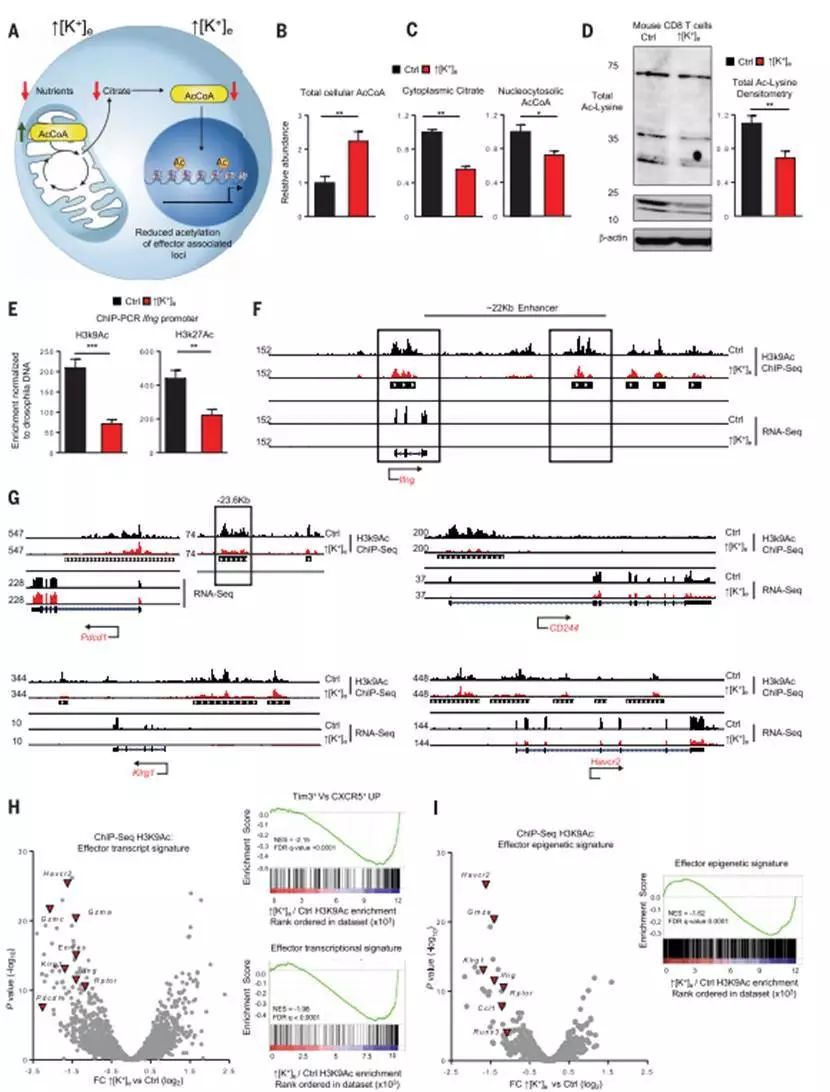
高浓度K+让T细胞恢复了干性
想要体内解除高浓度K+设下的禁制比较困难,那体外T细胞这一特性的利用是否能成为肿瘤治疗的契机呢?肿瘤免疫治疗的另一主要技术——过继性T细胞免疫治疗引起了研究人员的注意。过继性T细胞免疫治疗是指通过回输体外培养扩增的具体抗肿瘤活性的T细胞,从而直接杀伤肿瘤或激发机体抗肿瘤免疫反应的肿瘤治疗方法,多种证据指出,其成败的关键,就是T细胞的干性,也就是分化成效应T细胞的能力!而高浓度K+对T细胞干性的作用正中下怀!
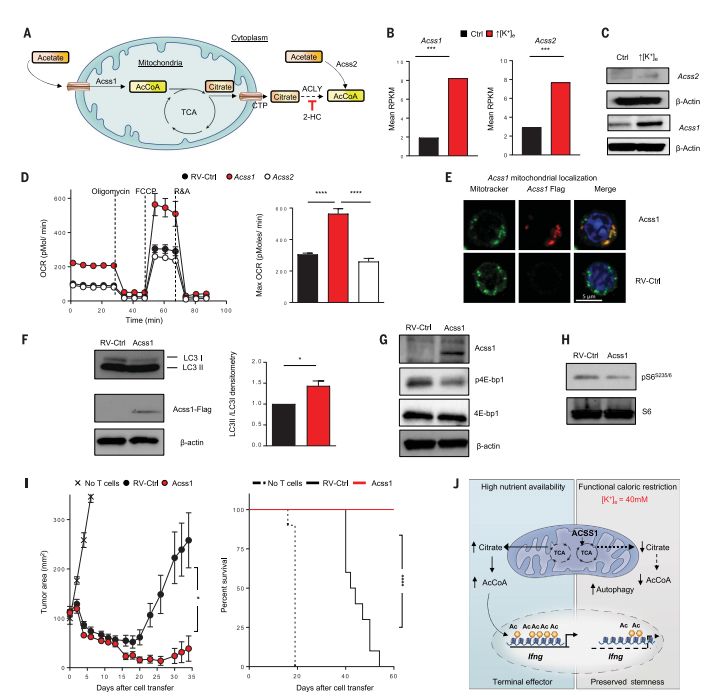
暴露于高浓度K+的体外环境中T细胞增强了抗肿瘤活性
研究人员将分离出的肿瘤浸润T细胞置于具有高浓度K+的体外环境中进行扩增,发现虽然这些T细胞的活性受到一定程度的抑制,但其与分化、效应相关的生物标志物水平明显升高。他们将这些扩增的T细胞回输入黑色素瘤小鼠体内,治疗效果令人振奋!这些小鼠30多天后的存活率高达100%(未治疗的小鼠20多天后全部死亡,普通T细胞输注的小鼠30天后死亡率为80%)!同时小鼠肿瘤获得了极好的控制!这为增强免疫治疗效果带来了绝佳契机!
真的是成也萧何败萧何!高浓度K+竟然给不同肿瘤免疫治疗方式带来了完全相反的效果,是利是弊还是要具体疗法决定。但于体内而言,TME的高浓度K+显然不是好事,控制K+浓度是免疫治疗的关键之一。而体外高浓度K+环境下的T细胞扩增回输也暂时只是动物实验结果,仍需更多时间和实验加以证明。好消息不会太远,我们拭目以待。
参考文献:
Suman Kumar Vodnala,et al.T cell stemness and dysfunction in tumors are triggered by a common mechanism.Science 29 Mar 2019.(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发