“基因魔剪”协助多能干细胞“突围”免疫排斥!|Nature子刊
| 导读 | 一个是充满希望的“种子细胞”,一个是当今基因编辑领域的神兵利器“基因魔剪”,这两者结合,将摩擦出怎样的火花?又会发生怎样的故事?且听美国加州大学的科学家娓娓道来..... |
一个是充满希望的“种子细胞”,一个是当今基因编辑领域的神兵利器“基因魔剪”,这两者结合,将摩擦出怎样的火花?又会发生怎样的故事?且听美国加州大学的科学家娓娓道来......
难以绕过的“天堑”
科学家经常对外宣讲多能干细胞的治疗潜力,它可以成熟分化为任何组织,而在干细胞移植领域,急需解决的就是“免疫排斥问题”。
机体免疫系统是“刚正不阿、铁面无私”的。它识别“异己”,保护身体免受传染因子和其他入侵者的侵害。但这也意味着,移植的器官、组织或细胞被均视为一种“危险的入侵者”,它总是引起强烈的免疫反应,会导致移植排斥。当发生这种情况时,医学上的说法是“组织相容性不匹配”。虽然可以使用某些药物,抑制机体免疫系统活性并减少免疫排斥。但这些免疫抑制剂降低了机体的免疫力,患者更容易感染和患癌症。
跨越“天堑”并非一帆风顺
科学家曾经认为排斥问题是通过诱导多能干细胞(iPSCs)解决的,这种干细胞是由完全成熟的细胞(如皮肤或脂肪细胞)产生的。如果将来自iPSCs的细胞移植到捐献原始细胞的同一患者体内,那么机体免疫系统会认为移植的细胞是“自我”,并且不会发生免疫攻击。
现实并非想象中那样美好。iPSC的临床应用已证明是困难的。由于尚未了解的原因,许多患者的细胞不接受重新编程。此外,为每位患者生产iPSC既昂贵又耗时。“iPSC技术存在许多问题,但最大的障碍是质量控制和可重复性。我们不知道是什么让一些细胞能够重新编程,但大多数科学家认为它还不能可靠地完成,”Deuse说。 “因此,大多数个体化iPSC治疗方法已被放弃。”
“一桥飞架南北,天堑变通途”
想必已经猜到,这个“桥”就是前面提到的“基因魔剪”CRISPR。不过还有一个小帮手,就是下文提及的“CD47”。
研究者想知道,是否有可能通过创建一种“通用”iPSC来回避这些挑战,这样,就可用于任何需要它们的患者。当然,可能性是有的,就是使用“基因魔剪”CRISPR进行基因编辑。说干就干,终于,理想的种子开花结果。
主要研究者Hoffman博士在新论文(Hypoimmunogenic derivatives of induced pluripotent stem cells evade immune rejection in fully immunocompetent allogeneic recipients)中,描述了在改变三个基因的活动之后,iPSC在被移植到具有完全功能免疫系统的组织后能够不引起免疫反应!

首先,研究人员使用“基因魔剪”CRISPR删除两个基因,这两个基因对于主要组织相容性复合体(MHC)I类和II类的蛋白质家族的正常功能至关重要。 MHC蛋白质位于几乎所有细胞的表面,并显示分子信号,帮助免疫系统分辨“入侵者”。缺少MHC基因的细胞不会出现这些信号,因此它们不会被识别为外来信号。
“长征”到这里并没有结束,接下来的研究发现,它虽然逃过了第一次“围剿”,但是,却招来了第二波“围剿”——缺失MHC蛋白的细胞却成为自然杀伤(NK)细胞的靶标。所以研究人员不得不寻求外援。研究人员与加州大学洛杉矶分校微生物学和免疫学系主任Lewis Lanier教授以及激活和抑制NK细胞活性的信号专家Schrepfer合作,发现细胞表面蛋白CD47充当“不要吃我”的信号,可逃避巨噬细胞的攻击,当然,它也能躲避NK细胞的攻击。
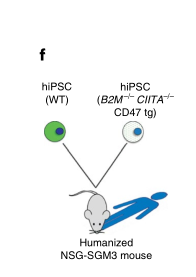
研究人员相信,细胞表面蛋白CD47可能是完全关闭排斥反应的关键所在。研究人员将CD47基因加载到一种病毒中,通过该病毒,传递给MHC蛋白缺失的小鼠和人体干细胞。当研究人员将他们的三重工程小鼠干细胞移植到具有正常免疫系统的错配小鼠时,他们没有观察到排斥反应。然后,他们将类似工程化的人类干细胞移植到人源化小鼠(其免疫系统已被人体免疫系统的成分所取代,以模仿人体免疫力)体内,并再次观察到没有引起免疫排斥反应。
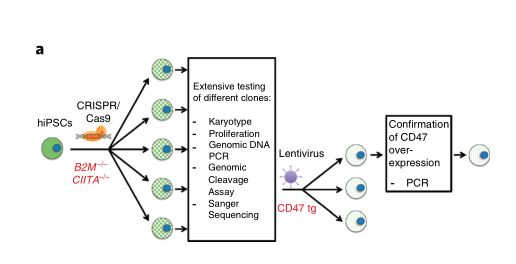
“我们显示当主要组织相容性复合物(MHC)I类和II类基因失活并且CD47过表达时,小鼠和人iPSC都失去其免疫原性。这些低免疫原性iPSC保留其多能干细胞潜能和分化能力。”作者在文提到。
不仅如此,研究人员从这些三重工程干细胞中衍生出各种类型的人类心脏细胞,并将它们再次移植到人源化小鼠体内。干细胞衍生的心肌细胞能够实现长期存活,甚至开始形成基本的血管和心肌,这为修复衰竭心脏带来了希望。
研究人员称,这是第一次设计出可以普遍移植的细胞,并且可以在免疫功能正常的受体中存活而不会引起免疫反应。这证明干细胞治疗领域又有一个大的进步。该项新技术可以使更多的人受益,并且,它的生产成本远低于任何个体化治疗方法——只需要制造低免疫原性细胞细胞一次,留下的产品可以做到“通用移植”。
参考资料:
[1]CRISPR gene editing makes stem cells 'invisible' to immune system
[2]Hypoimmunogenic derivatives of induced pluripotent stem cells evade immune rejection in fully immunocompetent allogeneic recipients
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发