新方法有望让阿尔茨海默症患者重拾记忆!
| 导读 | 数据显示,目前我国AD患者的人数已经超过1000万,而且患病人数将会持续上升。同时,预计到2030年,我国AD的经济负担将超过32000多亿元,2050年将超12万多亿元。但时至今日,依旧没有一套切实可行可治愈AD疗法,其对大脑的伤害始终积重难返。 |
数据显示,目前我国AD患者的人数已经超过1000万,而且患病人数将会持续上升。同时,预计到2030年,我国AD的经济负担将超过32000多亿元,2050年将超12万多亿元。但时至今日,依旧没有一套切实可行可治愈AD疗法,其对大脑的伤害始终积重难返。近日,纽约州立大学的华裔科学家Zhen Yan博士带领的研究团队指出表观遗传学修饰或是AD患者记忆障碍的真正原因,只要阻断相应通路就有望逆转AD患者的记忆衰退现象!简而言之,DNA序列以外的影响亦可引起基因表达变化,而这些变化或是AD治疗的关键!

AD记忆障碍的关键——谷氨酸受体丧失
AD是一种起病隐匿、进行性发展的神经系统退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征。而记忆与认知障碍是AD的突出症状,尤其在疾病后期,患者多无法保留最近的记忆信息,同时伴随严重的认知衰退。研究人员指出,其中的关键原因就是谷氨酸受体丧失。
谷氨酸是中枢兴奋性神经递质,存在于中枢神经系统的所有神经元,大脑皮质含量最高,其激活谷氨酸受体后能刺激神经生长、突触发生和成熟。谷氨酸通过谷氨酸受体介导中枢神经系统绝大多数突触的快速兴奋性突触传递,参与脑内诸多的功能活动。
海马和大脑皮质的N-甲基-D-天门冬氨酸(NMDA)受体特别多,激动时可促进学习和记忆。研究人员发现AD患者的额叶皮质中许多谷氨酸受体亚基被损毁,导致兴奋信号传递受损,造成记忆功能丧失。
也就是说,要想挽回AD患者失去的记忆,就必须防止谷氨酸受体的丢失,为此,必须弄清楚的一个问题是:谷氨酸受体为什么被破坏?
谷氨酸受体被毁——抑制性组蛋白修饰的恶果
我们普遍认为AD是多种因素(包括遗传和社会心理因素)的作用结果,而环境因素正是通过表观遗传修饰引起基因表达变化。研究人员对AD患者的死后脑组织进行切片,惊奇地发现其脑部H3K9me2(组蛋白第三亚基四号赖氨酸的三甲基化)明显增加,而AD小鼠的H3K9me2含量比正常小鼠增加了50%左右!
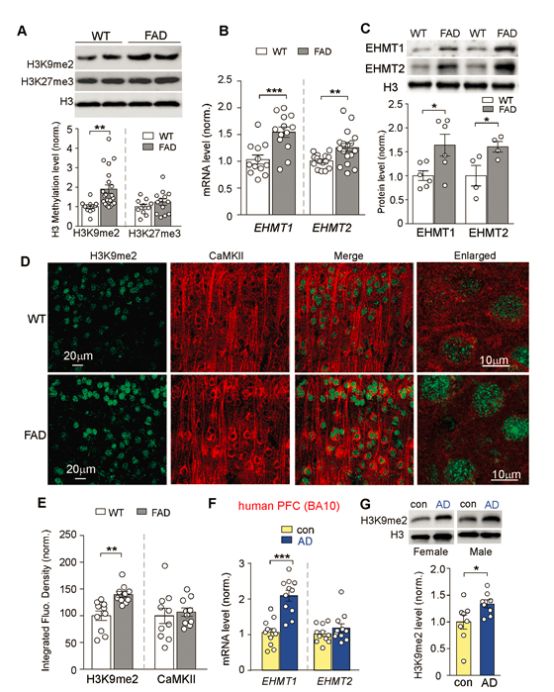
AD患者和AD小鼠H3K9me2显著增加
H3K9me2是与基因的激活与抑制相关的标记基因,由H3K9的甲基转移酶EHMT1/2将H3K9二甲基化后形成,有研究证实这是一种可以使人产生认知障碍的抑制性组蛋白修饰。但其导致认知障碍的机制一直众说纷纭。AD患者脑内谷氨酸受体稀少和H3K9me2剧增是否有联系呢?
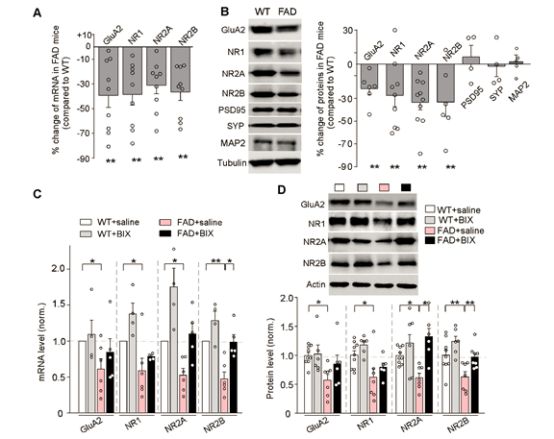
AD小鼠谷氨酸受体转录和表达缺失,证实由H3K9me2导致
研究人员发现,H3K9me2正是通过改变染色质结构,削弱了谷氨酸受体的转录途径,抑制基因表达,进而减少了谷氨酸受体,最终导致了突触功能缺陷和记忆丧失。换言之,H3K9me2就是谷氨酸受体缺失的真凶,要遏制AD患者的记忆障碍,最重要的就是减少H3K9me2的发生。
遏制H3K9me2的良方——EHMT1/2抑制剂
只有在EHMT1/2的作用下H3K9才能二甲基化形成H3K9me2,EHMT1/2是整个抑制性组蛋白修饰的关键酶,因此,想要抑制H3K9me2,EHMT1/2抑制剂就是最好的选择。研究人员将特异性EHMT1/2抑制剂注入AD小鼠体内,发现小鼠的H3K9me2含量显著减少,同时小鼠海马体内的兴奋性得到改善,这就意味着EHMT1/2抑制剂确实能缓解AD症状!
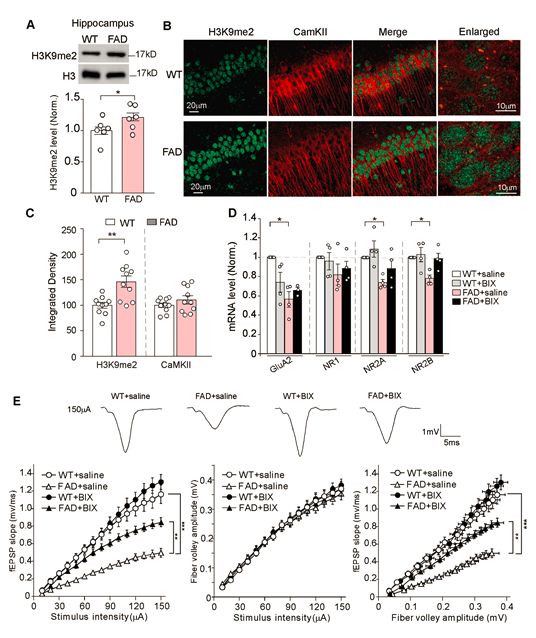
使用EHMT1/2抑制剂后AD小鼠症状明显改善
研究人员进一步验证了EHMT1/2抑制剂对AD患者的普遍作用。他们利用EHMT1/2抑制剂对AD小鼠的全基因组的突变进行标准化治疗。结果表明,77.7%AD小鼠中的H3K9me2明显减少,多数H3K9me2已被逆转。
虽然这项研究为AD相关的研究提供了新的方向,但若要真正走进临床仍需更多时间和实验结果来证明。同时这对AD患者来说是天降喜讯,为他们带来了一丝康复的希望。相信假以时日,AD患者能不再“老来多忘事”。
参考文献:
Alzheimer's disease: It may be possible to restore memory function, preclinical study finds
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发