《Cell》子刊:如何减缓肿瘤进展?利用DNA修复!
| 导读 | DNA修复机制在肿瘤的发生和进展过程中其到关键的作用。因此,研究人员不断探索靶向DNA修复机制关键蛋白在肿瘤疗中的作用。目前研究人员提出了对抗备用DNA修复机制的新方法。DNA修复关键工匠-BRCA蛋白被称为BRCA的蛋白质是BReastCAncer易感基因的缩写,这种蛋白在细胞DNA修复 |

DNA修复机制在肿瘤的发生和进展过程中其到关键的作用。因此,研究人员不断探索靶向DNA修复机制关键蛋白在肿瘤疗中的作用。目前研究人员提出了对抗备用DNA修复机制的新方法。
DNA修复关键工匠-BRCA蛋白
被称为BRCA的蛋白质是BReast CAncer易感基因的缩写 ,这种蛋白在细胞DNA修复中起关键作用。但是当它发生突变时,便可允许错误的遗传信息进行复制,进而促进肿瘤的发展。
如果BRCA修复系统在癌细胞中被抑制,细胞就会利用备用修复机制并逐渐适应替代修复途径,这也是肿瘤细胞逃避靶向药物关键机制之一。
现在 Lewis Katz 医学院(LKSOM)的科学家们进行了一项新的研究,使用两种靶向药物可以同时消除至少两种备用的修复机制。 这种靶向疗法有效地缩小了备用的修复途径,有助于消灭肿瘤细胞。
该研究发表于最新的Cell Reports上。这种新方法被称为双合成致死性,这是所谓的,因为肿瘤细胞的死亡是由两种靶向不同DNA修复途径的药物同时诱导,因此这种靶向技术被称为“双合成致死性”技术。

靶向阻断哪两个DNA修复备用通路呢?
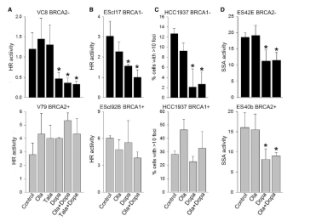
携带BRCA缺陷突变的肿瘤细胞通常依赖于被称为PARP1的蛋白介导的DNA修复。临床上,PARP1抑制剂可显着提高患有遗传性BRCA突变癌症患者的存活期。
然而,随着时间的推移,PARP1抑制的有效性下降,癌症复发。据Skorski博士介绍,发生这种情况是因为仅阻断一条途径是远远不够的。
他表示, ”肿瘤细胞最终通过激活另一个备用机制来逃避PARP1抑制。以前的工作表明RAD52依赖途径是另一条潜在的备用机制,这使我们看到了同时抑制PARP1和RAD52或可能够更强的抑制肿瘤进展的可能性”。
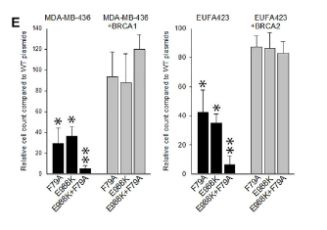
该团队首先在BRCA缺陷型实体瘤和白血病细胞中进行了一系列体外实验。结果表明,双重靶向治疗可彻底根除BRCA缺陷型肿瘤细胞。
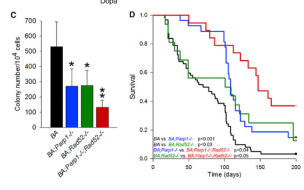
然后在小鼠中测试了该双重靶向技术。他们发现双重抑制在体内对肿瘤具有强烈的作用,其显示出比单独的任一种药物更高的活性。
重要的是,研究小组的实验表明,在体外和体内,具有正常BRCA活性的正常细胞不受双重靶向治疗的影响。保持正常细胞相对不受伤害有助于减少患者用药后的不良反应和副作用的发生。
双靶向抗肿瘤技术意义重大!
这项新研究不仅为开发临床可用的RAD抑制剂提供了基础,同时也提出了新的抗癌策略:首先进行BRCA基因检测,再根据基因是否缺陷进行双靶向药物的使用。
在未来,Skorski博士的团队还计划继续研究潜在的DNA修复替代途径,或许未来对DNA修复机制的多重阻断会更有益于临床抗肿瘤治疗。
参考文献:
Katherine Sullivan-Reed,Elisabeth Bolton-Gillespie,Yashodhara Da. Simultaneous Targeting of PARP1 and RAD52 Triggers Dual Synthetic Lethality in BRCA-Deficient Tumor Cells
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发