关节炎治疗新曙光——三价TNF受体面世!
| 导读 | 目前的TNF-α阻滞剂,包括可溶性受体-Fc融合蛋白和治疗性抗体,都是二聚体结构,但它们的靶标TNF-α本身在性质上是同三聚体,而三价可溶性TNF受体的发展攻克了这一难题 |

目前的TNF-α阻滞剂,包括可溶性受体-Fc融合蛋白和治疗性抗体,都是二聚体结构,但它们的靶标TNF-α本身在性质上是同三聚体,而三价可溶性TNF受体的发展攻克了这一难题,它在体内外对TNF-α信号传导的抑制,都比二聚体TNF受体更有效,这提高了对关节炎的治疗效果,同时也为下一代药物设计提供了更好的生物平台。
肿瘤坏死因子的作用机制
肿瘤坏死因子(TNF-α)是人体产生抗感染的主要促炎细胞因子,它为宿主提供了必要的炎症反应保护。 然而,TNF-α的异常持续释放可能导致自身免疫性疾病,如类风湿性关节炎(RA),牛皮癣等。 迄今为止,越来越多的证据表明,TNF-α是最原始的炎性细胞因子,它在自身免疫性疾病的发生和发展中起着决定性的作用。具有生物活性的TNF-α分子在体内以同三聚体的形式存在,并通过与细胞表面的三聚TNF-α受体(TNFR)结合而激活下游信号通路,导致受体三聚化和活化,进而触发级联反应而导致炎症。
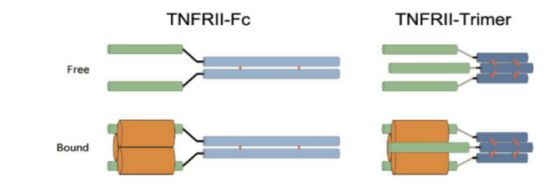
TNFRII-Fc(同型二聚体可溶性人TNFRII受体-Fc融合物)与依那西普以无配体或结合形式存在及TNFRII(三聚体可溶性人TNFRII受体-C前肽融合体)的结构特征
TNF细胞因子家族的所有成员在结构上都是同三聚体。因此,可溶性TNF受体与能够通过二硫键自发二聚化的免疫球蛋白G1的Fc区的融合,将允许可溶性TNF受体二聚体的分泌。与单体可溶性受体相比,二聚体TNF受体II-Fc融合体对同源三聚体配体具有更大的亲和力,这为阻断抗TNF受体药物依那西普用于治疗类风湿性关节炎(RA)提供了分子基础。
三价TNF受体的发展
肿瘤坏死因子(TNF-α)是炎症反应中最有效的介质之一,其异常表达在自身免疫性疾病的发病机制中起着重要作用,实际上,在临床上,TNF / TNFR系统代表了单一最大且经验证的治疗剂目标,是慢性自身免疫性疾病的主要治病因子,如类风湿关节炎和牛皮癣。

为了开发功效更强、更有效的TNF拮抗剂,研究员们在该研究中构建并展示了三聚体TNFRII融合蛋白TNFRII-Trimer。之前一种新型三聚体可溶性融合蛋白,在哺乳动物(CHO)表达系统中成功表达,该蛋白具有I型胶原C-前肽从而可作为三聚体折叠的Trail-Trimer。由于I型胶原蛋白是主要由两条α-1链和一条α-2链组成的异三聚体三螺旋分子,而由三条α-1链组成的I型胶原蛋白的同源三聚体同型体仅存在于胎儿组织,纤维化,和人类癌症。为了测试TNFRII-三聚体是否可以作为同源三聚体的可溶性受体或生物活性融合蛋白成功分泌,研究员们首先开发了CHO细胞系并补充无血清细胞培养过程,由此可以产生大量的TNFRII-三聚体,从而得到从细胞培养基中高度纯化的TNFRII-三聚体并用于进一步表征。
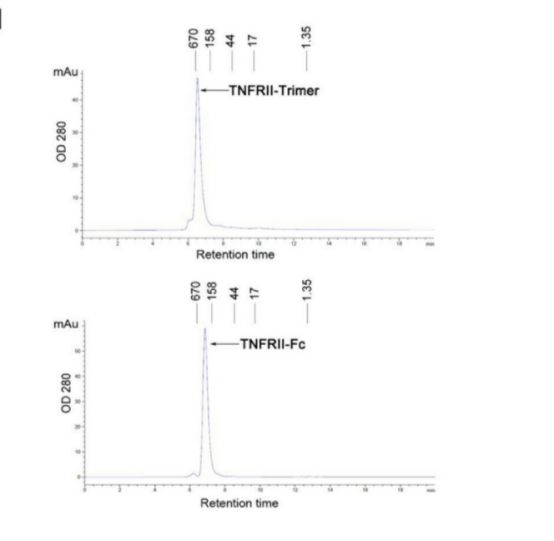
TNFRII-Fc与TNFRII-Trimer的有效作用浓度
为了验证体外三聚体TNFRII-Trimer的结构有效性和生物活性,研究者进行了一系列物理化学表征,并将其与TNFRII-Fc进行了对比分析。 TNFRII-Trimer的结构研究显示可溶性TNFRII-Trimer融合蛋白,实际上是二硫键结合的同源三聚体,由具有重糖基化的TNFRII和III型胶原C-前结构域组成。TNF-α基于L929细胞的生物测定证实TNFRII-Trimer能有效结合TNF-α,从而阻断配体诱导的细胞凋亡。这为解决胶原引起的关节炎问题带来了新的突破,并为下一代药物设计提供了更好的生物平台。
参考文献
Locksley, R. M., Killeen, N. & Lenardo, M. J. Trivalent soluble TNF Receptor, a potent TNF-α antagonist for the treatment collagen-induced arthritis
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发