《Nature》长文书衰老机制新篇章!华人科学家突破性研究
| 导读 | 就在前天,我们刚刚回顾了一篇外国人的长寿人群的研究,发现在群体中拥有生长激素相关的受体突变可以增长寿命。而在今天早上凌晨,代表着中国科研顶尖水平的中科院上海神经科学研究所的蔡时青研究员在《Nature》上发表了一篇文章,长达23页的文章书写衰老机制新篇章! |
北京时间,11月9日凌晨,一篇新鲜出炉的论文在线发表在《Nature》杂志。这篇名为“Genetic variation in glia–neuron signalling modulates ageing rate”的研究论文,是首篇揭示不同个体之间存在衰老速度差异的遗传基础是什么,并且阐明了神经肽介导的胶质细胞-神经元信号这一新的衰老调控机制在衰老速度调控中的重要作用,毫无疑问,这是近年来衰老领域取得的重要突破。而本次蔡时青教授领导的团队以及本文的作者也皆为华人科学家。
《Nature》报道
1、和果蝇一样棒的研究小伙伴:线虫
首先我们来认识一下衰老研究领域的明星,本项研究的功臣:线虫。
我们都知道果蝇在历来的诺贝尔奖得主的研究中都占有一席之地,包括今年的诺贝尔生物学奖。果蝇在遗传的研究中具备得天独厚的优势,而在衰老领域的研究中,线虫有着类似的光辉地位。
线虫的遗传背景清晰,且生命周期很短,同时个体小,成为理想的模式动物。在 20℃下,线虫平均发育时间为 3.5 天,整个生命周期约 21 天,因此科学家们可以很清楚的看到线虫的整个发育过程,而一旦线虫寿命增加的话,我们可以很轻松的观察到,如果一只线虫活到了40天,那就是寿命几乎翻了一倍。
但是,即便线虫可以方便科研人员进行观察,想要从中弄清楚衰老的机制也并不是一件简单的事情。
2.衰老速度到底与什么相关?
在生活中,我们往往发现相同年龄的人之间存在着明显的差异,有的老年人老态龙钟,有的却龙行虎步。这些情况表明不同的人在衰老速度上具有明显的差别。而这,也是本项研究的入手点,研究人员发现相同年龄的线虫在生命活力上存在着明显的差异,也就表明他们具有衰老速度上的差异。
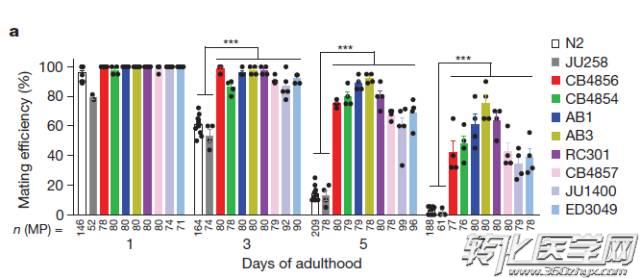
研究人员找来了各地10种不同的野生型秀丽隐杆线虫,分析不同生长期的功能性状,比如交配、喉咙吞咽,最终将研究锁定在交配能力上,图1反映了交配能力的变化差异
在基因组计划完成之后,人类明确了自己有多少个基因。而线虫基因组约有20000个,数目大致和人类相等,但是即便技术已经发展了这么久,如何去鉴定这些基因依旧是个旷日持久的工程,那么怎么可以尽快找到那些于衰老相关的基因呢?
蔡时青领导的研究团队想出来一个很棒的创意:将不同衰老速度的线虫杂交。
3.rgba-1基因——衰老调控第一站
这个实验设计的很有创意。
首先,将衰老速度慢的线虫同衰老速度快的线虫野合产生下一代,这个下一代中衰老依旧很快的个体再和最初衰老速度慢的个体产生下一代。那么在这个过程中,研究中那些衰老慢的个体中的杂鱼基因(和衰老不相关的基因)就会被剔除掉。
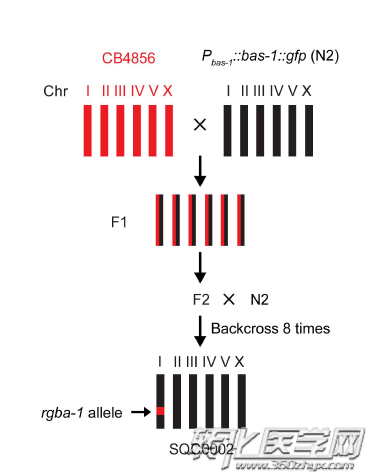
杂交过程
经历了八次的重复杂交,通过全基因组测序以及实验验证,研究人员将目标锁定在一个基因,并自主命名为rgba-1(regulatory-gene-for-behavioral-aging-1)基因。
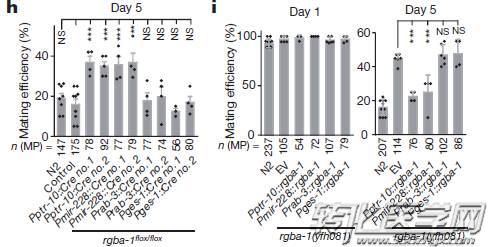
rgba-1基因对衰老速度影响的多态性
被锁定的rgba-1基因的职责是编码蛋白和信号肽,而这被认为是神经肽的前体物质。神经肽存在于神经组织,参与神经系统功能调节。
难道与年龄有关的行为衰退把谜底藏在了神经系统?
rgba-1基因编码产生的神经肽会去向哪里?
这个基因到底是怎么控制衰老进程的呢?
4.npr-28基因——衰老调控第二站
实现衰老调控的第二站到底走向了哪里?
rgba-1基因编码的神经肽的“命令”传给了谁?
通过RNA干扰技术,研究人员将目标锁定在npr-28基因,研究发现一旦敲除该基因,线虫就能有效地改善与年龄相关的交配能力衰退。
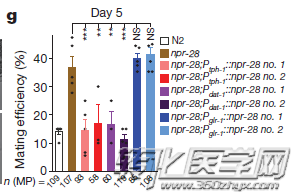
npr-28基因对交配能力的调节作用
不过,这一通路还没有全部完成,仍需借助SIR-2.1蛋白来实现对衰老速率的调节。此前,科学家已经认定,SIR-2.1蛋白是线粒体未折叠蛋白反应的调节器,而该反应和长寿相关。
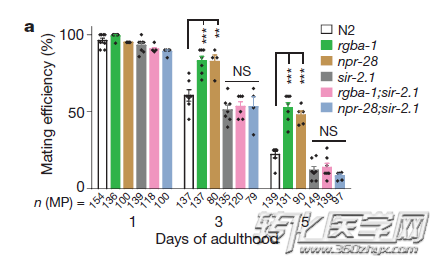
SIR-2.1蛋白对衰老速率调节的影响
至此,rgba-1-npr-28通路如何调控衰老速率的“路线图”绘制完毕。
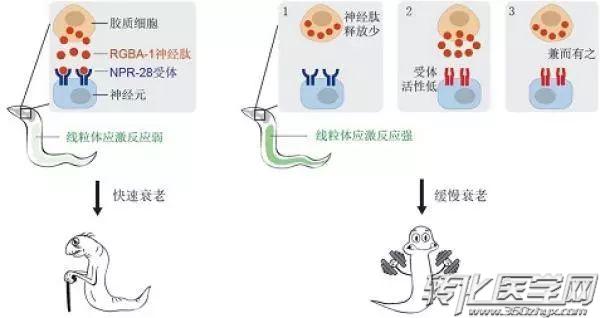
图片来源:澎湃新闻
这项突破性的发现为抗衰老研究打开了一扇全新的窗户,也为衰老的进化提供了新的认识。看到这,你是不是觉得自己向年轻又迈进了一步?
参考资料:Genetic variation in glia–neuron signalling modulates ageing rate
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发