前言
当前,传统的基于组织病理学分型的“一刀切”治疗模式,正逐渐被基于肿瘤基因组学特征的个体化治疗策略所取代。基因检测,特别是二代测序(Next-Generation Sequencing, NGS)技术的广泛应用,已成为连接基础研究与临床实践的关键桥梁,为癌症的诊断、治疗选择、预后判断及遗传风险评估提供了前所未有的精确信息。在临床实践中,面对复杂的肿瘤基因组,到底应该选择覆盖少数关键基因的“小Panel”检测,还是选择能够一次性扫描数百乃至数千个基因的“大Panel”检测?
须知,在肿瘤精准诊疗的决策过程中,获取全面、准确的基因变异信息才是制定有效治疗方案的前提。大Panel NGS检测凭借其技术优势,正逐渐成为晚期肿瘤患者的标准配置。
一、大Panel与小Panel的核心差异
要理解大Panel的价值,首先需要明确其与小Panel的根本区别。这不仅是检测基因数量上的差异,更体现在信息维度和临床应用广度的不同。
大Panel (Comprehensive Genomic Profiling, CGP):通常包含数百个甚至上千个与肿瘤发生发展相关的基因。其设计理念在于“全面”,不仅覆盖了所有已知可靶向治疗的驱动基因,还包括了耐药基因、罕见突变基因以及与免疫治疗相关的生物标志物(如TMB、MSI)。检测的变异类型也极为广泛,涵盖点突变(SNV)、插入/缺失(Indel)、拷贝数变异(CNV)、基因融合(Fusion)等多种形式
小Panel:通常包含少于50个基因,其设计更具“针对性”。例如,针对非小细胞肺癌,小Panel可能仅覆盖NCCN指南推荐的8个核心驱动基因(如EGFR、ALK、ROS1等)。它主要聚焦于特定癌种最常见、已有成熟靶向药物的基因,适用于诊断明确、治疗路径相对清晰的场景。
二、大Panel的应用场景与临床优势
大Panel的“全面性”使其在复杂的临床场景中展现出不可替代的优势,尤其适用于以下人群:
晚期或转移性肿瘤患者:这类患者往往需要探索所有可能的治疗机会,大Panel能够最大化地发现可靶向的突变,包括罕见突变。
多线治疗后耐药的患者:肿瘤在治疗压力下会发生基因组进化,产生耐药突变。大Panel能够同时检测原发和继发耐药机制,为后续治疗提供方向。
希望参与临床试验的患者:许多创新药物的临床试验都基于特定的分子标志物,大Panel检测结果可以作为患者入组筛选的“通行证”,为其带来前沿的治疗机会。
肿瘤来源不明(CUP)或罕见癌种患者:对于这类诊断困难的肿瘤,大Panel提供的全面基因组图谱有助于进行分子分型,甚至可能找到意想不到的治疗靶点。
相比之下,小Panel更适用于早期肿瘤患者(基因突变相对简单)、仅需验证特定通路或预算有限的情况
三、临床价值的实证:从数据看获益
大Panel的临床价值并非纸上谈兵,多项大规模真实世界研究为其提供了坚实的数据支持。
1. 显著提升可靶向突变检出率
以晚期结直肠癌为例,不同检测策略的阳性检出率差异巨大。如果仅检测KRAS基因热点突变,约40%的患者能被发现携带突变。若使用包含约50个基因的小Panel,检出率可提升至65%。而当采用覆盖超过400个基因的大Panel时,驱动基因突变的阳性检出率可高达99%。这意味着,大Panel检测能让几乎所有患者都获得一份有临床指导意义的分子图谱,避免了因检测范围不足而错失治疗良机。
2. 提高靶向治疗应用率,且不增加总医疗成本
一项覆盖26,311名癌症患者(包括肺癌、乳腺癌等6种癌症)的美国大型健康保险研究(2018-2022年数据)揭示了重要发现。研究显示,尽管整体分子检测率仍有待提高(35%),但接受全面基因组谱分析(CGP,即大Panel)的非小细胞肺癌和结直肠癌患者,接受靶向治疗的可能性显著高于非CGP检测组(非小细胞肺癌OR=1.57, P<.001; 结直肠癌OR=2.34, P<.001)。具体而言,CGP组接受靶向治疗的比例为12%,而非CGP组仅为6%。
更令人关注的是,尽管CGP检测本身成本较高,但从整体治疗周期来看,CGP检测组与非CGP检测组的总医疗成本并无统计学上的显著差异。这表明,通过更精准的靶向治疗,大Panel检测可能减少了无效治疗和相关副作用处理的费用,实现了“增效不增负”的成本效益平衡。
3. 一次检测,多重信息获益
大Panel的价值远不止于指导靶向治疗,它提供了一站式的解决方案:
指导免疫治疗:通过分析肿瘤突变负荷(TMB)和微卫星不稳定性(MSI)等全基因组特征,为PD-1/PD-L1抑制剂等免疫检查点抑制剂的使用提供关键依据。
优化组织样本管理:对于穿刺活检等方式获取的珍贵组织样本,一次大Panel检测即可获得所有需要的信息,避免了因多次单基因检测而耗尽样本的窘境。
揭示遗传风险:大Panel检测可以同时分析胚系突变,帮助患者及其家属了解遗传性肿瘤综合征的风险,指导早期筛查和预防。
综上所述,大Panel NGS检测通过提供最全面的基因组信息,最大化了患者从精准医疗中获益的可能性。它不仅提高了靶向突变的检出率,还为免疫治疗、临床试验入组和遗传风险评估提供了关键信息,是实现个体化癌症治疗不可或缺的工具。
四、NGS在常见实体瘤中的临床应用实践
NGS检测的临床价值最终体现在其对具体癌种诊疗决策的指导上。以下将结合最新指南和临床研究,深入剖析NGS在多种实体瘤中的应用实践。
1. 非小细胞肺癌
NSCLC是精准医疗实践最为成熟的领域之一。《非小细胞肺癌分子病理检测临床实践指南(2024版)》明确指出,应基于患者个体情况、肿瘤类型和突变频率等因素综合考虑基因检测的选择。对于晚期NSCLC患者,大Panel NGS检测已成为探索治疗可能性的重要手段,尤其是在耐药机制的探索上。
(1)EGFR-TKI耐药机制的探索
EGFR酪氨酸激酶抑制剂(TKI)的出现彻底改变了EGFR突变阳性NSCLC的治疗格局。然而,获得性耐药几乎不可避免。NGS检测能够精准识别复杂的耐药机制,指导后续治疗。这些机制主要分为两大类:
On-target耐药:指EGFR基因本身发生新的改变,如经典的T790M突变(对一、二代TKI耐药),以及在三代TKI奥希替尼耐药后出现的C797S顺式/反式突变、EGFR扩增等。例如,一线奥希替尼耐药后,C797S突变在Ex19Del患者中发生率约10%,在L858R患者中约3%。
Off-target耐药(旁路激活):指激活了独立于EGFR的其他致癌信号通路。最常见的旁路激活是MET基因扩增,在三代TKI一线治疗耐药后发生率可达15%-20%。其他旁路还包括HER2扩增、KRAS/BRAF突变、RET/ALK融合等。
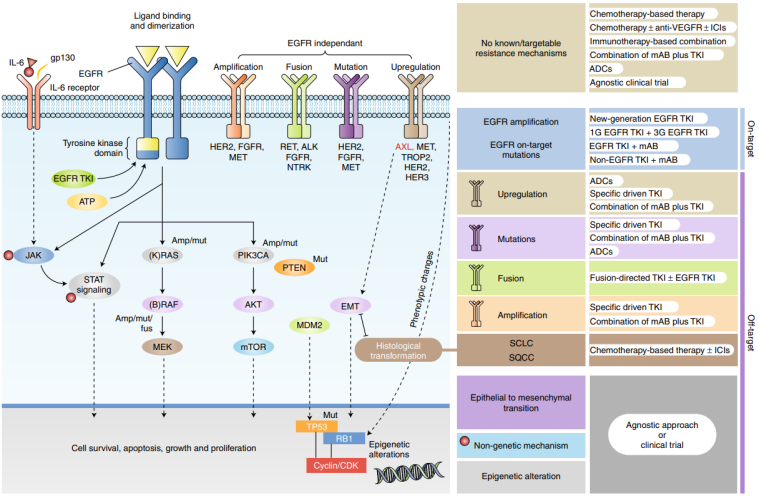
图1. EGFR信号转导通路、获得性耐药机制及相关潜在治疗策略
NGS检测能够一次性厘清这些复杂的耐药图谱,为联合用药或更换治疗方案提供依据。例如,对于MET扩增介导的耐药,可考虑联合使用MET抑制剂(如赛沃替尼、卡马替尼)与EGFR-TKI。临床研究数据显示,赛沃替尼联合奥希替尼在MET继发扩增的患者中取得了良好的疗效(ORR 48%-64%)。
(2)非小细胞肺癌MET扩增靶向治疗临床数据
针对MET扩增,无论是原发性还是继发性,多种靶向药物已在临床研究中显示出疗效。以下表格汇总了部分关键数据:
表1-1. MET原发扩增靶向药物关键临床研究数据
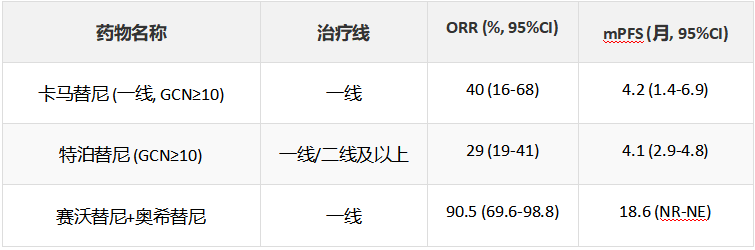
表1-2. MET继发扩增靶向药物关键临床研究数据
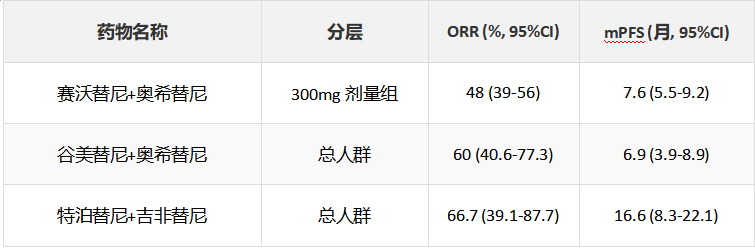
注:ORR为客观缓解率;mPFS为中位无进展生存期;GCN为基因拷贝数;NR为未达到;NE为未评估。
(3)罕见EGFR突变(PACC突变)的治疗指导
除了经典的Ex19Del和L858R突变,还存在G719X、S768I、L861Q等罕见突变,统称为PACC(Primary Atypical and Compound EGFR mutations)突变。根据《EGFR PACC突变晚期非小细胞肺癌诊疗专家共识(2025版)》,不同代际的EGFR-TKI对这些罕见突变的疗效各异。例如,二代TKI阿法替尼在G719X突变患者中显示出良好的活性(ORR 77.8%)。而对于某些复合突变,三代TKI如奥希替尼也展现出一定疗效。NGS检测是准确识别这些罕见及复合突变类型的唯一可靠手段,对指导药物选择至关重要。
2. 结直肠癌
结直肠癌的分子分型和靶向治疗同样取得了长足进步。《结直肠癌分子病理检测临床实践指南(2025版)》对不同阶段的检测项目提出了明确建议。NGS大Panel检测能够一站式覆盖所有推荐及潜在的生物标志物。
(1)常规与扩展检测标志物
常规检测:
RAS (KRAS/NRAS) 突变:抗EGFR治疗(西妥昔单抗、帕尼单抗)的核心负向预测标志物,约40-50%的mCRC患者携带RAS突变,对此类药物无效。
BRAF V600E突变:强效不良预后标志物,约占mCRC的5%-10%。携带此突变的患者可从BRAF抑制剂联合抗EGFR抗体治疗中获益。
MMR/MSI状态:dMMR/MSI-H是免疫检查点抑制剂的强效预测标志物,约占CRC总数的15%。
HER2扩增:在RAS/BRAF野生型患者中,HER2扩增是抗HER2治疗的靶点,患者可从曲妥珠单抗联合帕妥珠单抗等方案中获益。
扩展检测:
NTRK/RET融合:罕见但具有高效靶向药物(如拉罗替尼、普拉替尼)的靶点。
POLE/POLD1突变:导致肿瘤超高突变负荷,是潜在的免疫治疗优势人群。根据CSCO 2025指南更新,对于携带致病性POLE/POLD1突变的MSS/pMMR患者,三线及以后治疗可考虑PD-1±CTLA-4抑制剂。
MRD (分子残留病灶):通过检测ctDNA中的肿瘤特异性突变,MRD可用于监测术后复发风险,并有望指导II期结肠癌患者的辅助化疗决策。
(2)遗传性结直肠癌的筛查
指南还强调了对遗传易感性的评估。对于有家族史或临床特征高度提示遗传综合征(如林奇综合征、家族性腺瘤性息肉病等)的个体,即使单一基因检测阴性,也推荐进行多基因胚系检测。推荐的基因Panel至少应包括APC、MLH1、MSH2、MSH6、PMS2、MUTYH、PTEN、STK11等核心基因。
3. 胶质瘤
与其他实体瘤不同,胶质瘤的分子检测结果直接定义了疾病的WHO分型和分级。《胶质瘤分子病理诊断中国专家共识(2025版)》强调,整合诊断已成为金标准。NGS是实现这一目标的核心技术。
关键分子标志物:
IDH1/2突变:是胶质瘤分类的第一个分水岭。IDH突变型肿瘤预后相对较好。
1p/19q共缺失:结合IDH突变状态,用于诊断少突胶质细胞瘤。此类肿瘤对PCV化疗和替莫唑胺更敏感。
ATRX缺失/p53过表达:结合IDH突变状态,用于诊断星形细胞瘤。
CDKN2A/B纯合性缺失:在IDH突变型星形细胞瘤中,该缺失直接定义其为WHO 4级。
TERT启动子突变、EGFR扩增、+7/-10染色体改变:在IDH野生型弥漫性胶质瘤中,出现任一改变即可诊断为胶质母细胞瘤(WHO 4级),预后差。
MGMT启动子甲基化:预测替莫唑胺和放疗疗效的经典标志物,甲基化阳性患者预后更佳。
NGS大Panel能够同时检测以上所有点突变、拷贝数变异和染色体改变,为胶质瘤的精准分型、分级和预后判断提供一体化解决方案。
4. 乳腺癌
乳腺癌是一个高度异质性的疾病,NGS检测在不同亚型中的应用侧重点各不相同。根据2024年更新的共识声明,NGS在晚期乳腺癌中的作用日益凸显。
(1)HR+/HER2- 乳腺癌
这是最常见的乳腺癌亚型,约占70%。内分泌治疗是基石,但耐药是主要挑战。NGS检测有助于揭示耐药机制并指导后续治疗。
ESR1激活突变:内分泌治疗耐药的明确标志物。EMERALD研究显示,对于ESR1突变患者,新型口服SERD药物依拉司群相比标准内分泌治疗能显著延长PFS(3.8 vs 1.9个月)。
PIK3CA突变:约40%的HR+患者携带此突变。SOLAR-1研究证实,PI3Kα抑制剂阿培利司联合氟维司群可将PFS几乎翻倍(11.0 vs 5.7个月)。
AKT通路改变:CAPItello-291研究表明,对于携带PIK3CA/AKT1/PTEN改变的患者,AKT抑制剂卡帕塞替尼联合氟维司群能显著改善PFS(7.3 vs 3.7个月)。
胚系BRCA1/2突变:约9%的HR+患者携带。OlympiAD研究显示,PARP抑制剂奥拉帕利单药治疗相比标准化疗,能为这类患者带来PFS获益(7.0 vs 4.2个月)。
CDK4/6抑制剂耐药:FAT1、RB1等基因的突变与CDK4/6抑制剂的耐药相关,检测这些基因有助于预测疗效和选择后续方案。
(2)HER2+ 乳腺癌
抗HER2靶向治疗是HER2+乳腺癌的核心,但耐药依然存在。NGS可用于评估耐药机制。
PIK3CA突变:是HER2+乳腺癌中的不良预后标志物。CLEOPATRA研究显示,无论是否使用帕妥珠单抗,PIK3CA突变患者的PFS均短于野生型患者。
ERBB2 (HER2) 激活突变:除了基因扩增,HER2基因本身的点突变也是一种激活机制。mutHER/SUMMIT研究发现,对于HER2扩增阴性但存在激活突变的患者,酪氨酸激酶抑制剂(TKI)奈拉替尼可以带来获益。
此外,一个新兴的概念是“HER2低表达”。这类患者基数庞大,约为HER2阳性的3倍。根据2024 CSCO指南,对于HER2低表达的患者,特别是化疗失败后,抗体药物偶联物(ADC)如T-DXd(德曲妥珠单抗)显示出卓越疗效,重新定义了治疗格局。
(3)三阴性乳腺癌 (TNBC) 与“复旦分型”
TNBC因缺乏明确的靶点,治疗手段有限,预后较差。NGS检测对于识别可靶向的亚群至关重要。
BRCA1/2突变:约10-15%的TNBC患者携带胚系或体系BRCA1/2突变,是PARP抑制剂的优势人群。
DNA损伤修复(HRR)通路基因:除BRCA1/2外,PALB2等其他HRR通路基因的突变也可能使患者从PARP抑制剂中获益。
PI3K/AKT通路变异:约41%的TNBC患者存在该通路变异,LOTUS研究提示AKT抑制剂Ipatasertib联合紫杉醇可能带来PFS获益。
更进一步,基于基因组和转录组学的“复旦分型”将TNBC细分为四个亚型,为更精准的治疗提供了理论依据:
腔面雄激素受体型 (LAR):表达雄激素受体,可能对内分泌治疗、抗HER2或CDK4/6抑制剂敏感。
免疫调节型 (IM):富含免疫细胞浸润,是免疫治疗的优势人群。
基底样免疫抑制型 (BLIS):存在基因组不稳定性(如BRCA1/2突变),可能对铂类或PARP抑制剂敏感。
间充质型 (MES):具有肿瘤干细胞特征,可能适合抗血管生成或靶向肿瘤干细胞的治疗。
同样,“复旦分型”也将传统的腔面型乳腺癌(HR+)细分为经典腔面型、免疫型、增殖型和RTK驱动型,分别对应内分泌治疗、免疫治疗、CDK4/6抑制剂和TKI治疗,为HR+乳腺癌的异质性提供了更深层次的解读。
5. 卵巢癌
卵巢癌的治疗已进入“手术+化疗+维持治疗”的慢病化管理模式,分子检测在其中扮演核心角色。
(1)基因检测指南与核心标志物
指南推荐对所有卵巢癌患者进行遗传易感基因评估,特别是BRCA1/2基因检测和/或HRD(同源重组修复缺陷)状态检测。
BRCA1/2突变:约20-30%的高级别浆液性癌患者携带BRCA1/2突变,是PARP抑制剂(如奥拉帕利、尼拉帕利)最强的疗效预测指标。
HRD状态:HRD阳性但BRCA野生型的患者同样能从PARP抑制剂维持治疗中显著获益。HRD检测将PARP抑制剂的优势人群从约25%的BRCA突变人群扩大到约50%的HRD阳性人群。
对于复发患者,还推荐检测MSI、TMB等,以探索免疫治疗的机会。
(2)不同组织学亚型的分子特征
NGS揭示了不同病理亚型具有独特的基因突变谱:
高级别浆液性癌:TP53突变率>96%,BRCA1/2突变和HRD阳性比例高。
子宫内膜样癌:CTNNB1、PIK3CA、ARID1A突变常见,且有较高比例的dMMR/MSI-H (23-32%)。
透明细胞癌:ARID1A、PIK3CA突变常见。
黏液性癌:KRAS突变率高 (30-50%)。
这些分子特征不仅指导靶向治疗和免疫治疗,也加深了对不同亚型生物学行为的理解。
6. 胃癌与胃肠间质瘤
(1)胃癌
胃癌是高度异质性的肿瘤,TCGA和ACRG两大分子分型系统为理解其复杂性提供了框架。
TCGA分型:
EBV阳性型 (9%):特点是DNA高甲基化、PIK3CA突变、PD-L1/L2扩增,提示对免疫治疗可能敏感
MSI型 (22%):高突变率,预后良好,是免疫治疗的绝对优势人群。
基因组稳定型 (GS, 20%):弥漫型多见,常有CDH1、RHOA突变,预后较差。
染色体不稳定型 (CIN, 50%):最常见亚型,以TP53突变和RTK基因扩增为特征。
ACRG分型:同样将胃癌分为MSI-H、MSS/EMT、MSS/TP53+和MSS/TP53-四型,与预后密切相关,其中MSS/EMT型预后最差。
NGS检测是实现这些分子分型的基础,并能识别如HER2扩增(曲妥珠单抗靶点)、FGFR2扩增/融合等多个治疗靶点。
(2)胃肠间质瘤 (GIST)
GIST是由特定驱动基因突变主导的肿瘤,NGS检测对其诊断和治疗至关重要。
经典驱动型GIST:绝大多数由KIT或PDGFRA基因突变驱动。
KIT突变:最常见,尤以exon 11突变(60-70%)为主,对伊马替尼反应良好。Exon 9突变(10-15%)则需要更高剂量的伊马替尼。
PDGFRA突变:其中D842V突变(约5%)对伊马替尼原发耐药,但对新型TKI如Avapritinib敏感。
野生型GIST:约10-15%的GIST缺乏KIT/PDGFRA突变,NGS可发现其他罕见驱动因素:
SDH缺陷型 (5-7%):由SDHA/B/C/D基因失活引起,多见于年轻人。
BRAF/RAS通路突变型 (1-3%):如BRAF V600E突变。
NF1相关型 (1-3%):与神经纤维瘤病1型相关。
NTRK融合型 (<1%):极为罕见,但对TRK抑制剂高度敏感。
7. 肝胆肿瘤
肝胆肿瘤包括肝细胞癌(HCC)、肝内胆管癌(iCCA)、肝外胆管癌(eCCA)和胆囊癌(GBC),其分子景观差异显著,NGS检测为这些难治性肿瘤带来了新的治疗希望。
根据《肝胆肿瘤分子诊断临床应用专家共识(2024年版)》,关键的可靶向变异包括:
IDH1/2突变:主要见于iCCA (7-30%),IDH1抑制剂艾伏尼布已获批用于治疗携带IDH1突变的晚期胆管癌患者,显著改善生存。
FGFR2融合:同样是iCCA的特征性改变 (5-16%),FGFR抑制剂佩米替尼、Futibatinib等已成为这类患者的标准治疗,ORR可达35.5%。
BRAF V600E突变:在胆道系统肿瘤(BTC)中发生率约1-5%,达拉非尼联合曲美替尼的“达曲”方案显示出高达51%的ORR。
HER2过表达/扩增:在GBC中发生率较高 (15-20%),抗HER2治疗(如泽尼达妥单抗)在临床试验中展现了潜力。
NTRK/RET融合:泛癌种靶点,虽然在肝胆肿瘤中罕见(<1%),但一旦检出,患者可从拉罗替尼或普拉替尼等高效靶向药中获得巨大生存获益。
HRD (同源重组修复缺陷):在HCC和CCA中发生率分别约为28.7%和20.8%,提示PARP抑制剂可能有效。
8. 肾癌
肾癌的分子病理学研究同样深入,NGS揭示了不同亚型独特的基因组特征,并为预后分层和靶向治疗提供了依据。
(1)透明细胞肾细胞癌
透明细胞肾细胞癌(ccRCC)是最常见的肾癌亚型,其基因组特征相对明确:
VHL基因失活:是ccRCC的标志性事件,发生率高达80%以上,导致HIF通路异常激活,是多种靶向药物(如HIF-2α抑制剂Belzutifan)的作用基础。
染色质重塑基因突变:PBRM1 (41-50%)、SETD2 (18-20%)、BAP1 (8-13%) 是另外三个高频突变基因。这些基因的突变状态与预后密切相关。
(2)其他病理亚型
非透明细胞肾癌的基因组特征呈现高度异质性,与透明细胞肾癌相比具有不同的驱动基因和预后特征,为精准医疗提供了新的挑战和方向。
乳头状肾细胞癌 (pRCC):分为1型和2型,具有不同的分子特征和预后。1型pRCC常伴有MET基因突变或扩增,与透明细胞癌的SETD2、PBRM1等突变不同;2型pRCC预后通常较差,与遗传性平滑肌瘤病相关的肾癌(由FH基因突变引起)多为2型。
嫌色细胞肾细胞癌 (chRCC):具有独特的体细胞基因组改变景观,但缺乏像ccRCC那样高频的驱动基因突变。目前研究认为其发生与特定的基因组不稳定模式有关。
集合管癌 (CDC):一种罕见但侵袭性极强的肾癌亚型,其分子机制研究相对较少,目前尚未发现明确的高频驱动基因。
(3)基于NGS的预后风险分层
2024年发表于《Nature Communications》的一项研究指出,特定的基因组特征可作为独立的预后不良因素:
BAP1失活突变:与肿瘤的侵袭性和较差的预后显著相关。
多克隆驱动事件:同时存在BAP1、PBRM1、SETD2或PTEN等多个驱动基因的截断突变,提示肿瘤异质性高,侵袭能力更强,预后更差。
拷贝数变异 (CNVs):3p、9p21和14q25等区域的早期拷贝数丢失与临床快速进展相关。
这种基于基因组的风险分层,能够帮助临床医生为患者制定更个性化的术后随访和治疗策略。
9. 其他癌种
NGS的价值也体现在更多癌种中:
子宫内膜癌:基于POLE、MSI、p53等状态的分子分型已写入指南,直接指导预后判断和辅助治疗决策。POLE超突变型预后极佳,p53异常型预后最差,需强化治疗。
尿路上皮癌:国际共识将其分为六种分子亚型(如管腔乳头状型、基底/鳞状型等),各亚型对化疗、FGFR抑制剂和免疫治疗的反应不同,为治疗选择提供了新维度。
甲状腺癌:不同病理亚型由不同基因驱动(PTC-BRAF/RET, MTC-RET, FTC-RAS),NGS可精准识别,指导TKI药物的使用。
恶性黑色素瘤:约50%为BRAF突变,25%为NRAS突变,15-20%为NF1突变,NGS检测是指导BRAF/MEK抑制剂、MEK抑制剂等靶向治疗的前提。
五、更多应用与展望
NGS指导化疗“增效减毒”——药物基因组学的实践:除了指导靶向治疗和免疫治疗,NGS在传统化疗领域同样大有可为。通过检测与药物代谢相关的单核苷酸多态性(SNP),可以预测患者对特定化疗药物的毒副反应风险,实现真正的个体化用药,即“增效减毒”。
NGS助力遗传性肿瘤风险评估:NGS多基因Panel检测在识别具有遗传易感性的高风险个体和家庭方面具有不可估量的价值。美国临床肿瘤学会(ASCO)发布的《Selection of Germline Genetic Testing Panels in Patients With Cancer: ASCO Guideline》为临床实践提供了明确指导。指南强调,当临床怀疑存在遗传性时,应考虑进行多基因Panel检测,而不仅仅是单个基因。
NGS技术仍在不断进化,其在肿瘤领域的应用边界也在持续拓展。液态活检、MRD监测和人工智能的融合,正在描绘一幅更加智能、动态和无创的肿瘤管理蓝图。
六、迈杰医学检测方案
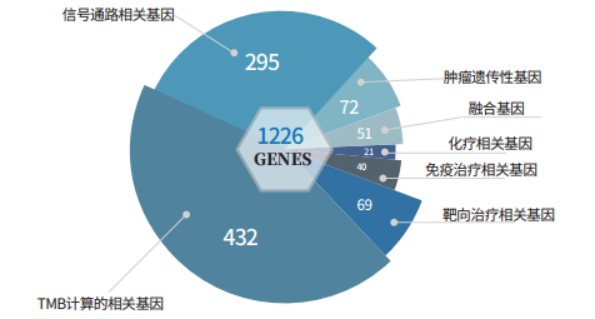
迈杰医学(MEDx)提供实体瘤1226基因检测(GRNK 1226 Panel)服务,参考NCCN、FDA、NMPA、CSCO等指南、指导,囊括FDA批准的两大国际权威Panel FoundationOne、MSK-IMPACT基因,此外还参考中国家族遗传性肿瘤基因突变数据库、OncoKB、COSMIC等疾病数据库、国内外相关公司的Panel List,涵盖靶向治疗相关基因、免疫治疗相关基因、肿瘤遗传性基因、化疗相关基因等,总计1226个基因。
图2. GRNK 1226 Panel 概览
1. 产品性能指标:

2. 产品优势:
全面覆盖NCCN推荐的各肿瘤用药靶点相关基因,可检测SNV、Indel、Fusion、CNV变异类型,提供全面的靶向用药指导,涵盖BRCA1/2等HRR相关基因,提供PARP抑制剂临床用药指导等;
检测结果包括TMB、MSI、HLA,指导免疫治疗,提供疗效预测和预后信息,指导免疫检查点抑制剂的临床应用和5-FU化疗使用;
检测肿瘤遗传易感基因的胚系突变,辅助遗传性肿瘤基因解读;
检测包括化疗用药基因,提示及解析化疗用药效果。
结语
肿瘤NGS检测,特别是大Panel的全面基因组谱分析,已经转变为现代肿瘤临床实践中不可或缺的组成部分,真正实现了“一次检测,多重获益”。NGS的应用已经深入到肿瘤诊疗的每一个环节,结合液态活检、MRD监测等新兴技术,NGS正在引领肿瘤治疗从“静态”的单次决策,迈向“动态”的全程管理新范式。
未来,随着检测成本的进一步降低、检测流程的持续优化以及AI辅助解读能力的不断增强,NGS技术必将惠及更多癌症患者,推动精准医疗进入一个更加普及和智能化的新时代,为战胜癌症提供更强大的科技武器。
参考文献
[1]. 非小细胞肺癌分⼦病理检测临床实践指南(2024)
[2]. EGFR PACC突变晚期非小细胞肺癌诊疗专家共识(2025)
[3]. 结直肠癌分子病理检测临床实践指南(2025)
[4]. 胶质瘤分子病理诊断中国专家共识(2025)
[5]. 晚期乳腺癌二代测序临床应用专家共识(2024)
[6]. 卵巢癌分子病理检测临床应用指南(2025)
[7]. 卵巢癌 PARP 抑制剂临床应用指南(2025)
[8]. 子宫内膜癌分子分型临床应用中国专家共识(2024)
[9]. 胃癌高通量测序临床应用中国专家共识(2023)
[10]. 肝胆肿瘤分子诊断临床应用专家共识(2024)
[11]. 肾细胞癌诊断分子分型专家共识(2022)
[12]. 化疗相关腹泻全程管理中国专家共识(2025)
[13]. Siwei Z, Ding M A, Yizhou J, et al. “Subtype-precise” therapy leads diagnostic and therapeutic innovations: a new pattern for precision treatment of breast cancer[J]. China Oncology, 2024, 34(11): 1045-1052.
[14]. Passaro A, Jänne P A, Mok T, et al. Overcoming therapy resistance in EGFR-mutant lung cancer[J]. Nature Cancer, 2021, 2(4): 377-391.
[15]. Kehl K L. Biomarker Testing in Advanced Cancer[J]. JAMA Network Open, 2025, 8(7): e2519972-e2519972.
[16]. Casali P G, Blay J Y, Abecassis N, et al. Gastrointestinal stromal tumours: ESMO–EURACAN–GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Annals of oncology, 2022, 33(1): 20-33.
[17]. Tung N, Ricker C, Messersmith H, et al. Selection of germline genetic testing panels in patients with cancer: ASCO guideline[J]. Journal of Clinical Oncology, 2024, 42(21): 2599-2615
[18]. Lu D, Dong C, Wang K, et al. Updates of CSCO guidelines for colorectal cancer version 2025[J]. Chinese Journal of Cancer Research, 2025, 37(3): 297.
[19]. Kim J W, Na H Y, Lee S, et al. Clinical implementation of next-generation sequencing testing and genomically-matched therapy: a real-world data in a tertiary hospital[J]. Scientific Reports, 2025, 15(1): 2171.
[20]. Vakkalagadda C V, Dressler D B, Sun Z, et al. The Impact of Next-Generation Sequencing Workflows on Outcomes in Advanced Lung Cancer: A Retrospective Analysis at One Academic Health System[J]. Cancers, 2024, 16(21): 3654.
[21]. Aredo J V, Jamali A, Zhu J, et al. Liquid Biopsy Approaches for Cancer Characterization, Residual Disease Detection, and Therapy Monitoring[J]. American Society of Clinical Oncology Educational Book, 2025, 45(3): e481114.
[22]. Colomer R, Gonzalez-Farre B, Ballesteros A I, et al. Biomarkers in breast cancer 2024: an updated consensus statement by the Spanish Society of Medical Oncology and the Spanish Society of Pathology[J]. Clinical and Translational Oncology, 2024, 26(12): 2935-2951.
[23]. Serna-Blasco R, Mediavilla-Medel P, Medina K, et al. Comprehensive molecular profiling of advanced NSCLC using NGS: Prevalence of druggable mutations and clinical trial opportunities in the ATLAS study[J]. Lung Cancer, 2025: 108550.
[24]. Gremke N, Rodepeter F R, Teply-Szymanski J, et al. NGS-guided precision oncology in breast cancer and gynecological tumors—a retrospective molecular tumor board analysis[J]. Cancers, 2024, 16(8): 1561.
迈杰转化医学研究(苏州)有限公司(以下简称为:迈杰医学)于2013年成立,前身为QIAGEN转化医学研究中心。作为伴随诊断整体解决方案领导者,拥有综合转化医学技术支持药物临床转化、伴随诊断产品(CDx)开发和用药指导检测三大业务,基于基因组学、蛋白组学、细胞组学,病理组学以及大数据与AI等综合技术平台,一流的产品开发团队与完善的研发流程,以及完善的质量体系(涵盖CAP、CNAS ISO 17025、ISO13485、GMP、GSP等), 迈杰医学围绕靶向治疗,免疫治疗及细胞/基因治疗,赋能药物临床转化研究并开发对应的伴随诊断产品,支持药物上市后的精准用药。迈杰医学已与全球400+创新药企及技术公司展开合作,已开发验证了数百个生物标记物及方法学,支持上百个药物临床试验。截至目前共有20+款产品获得药监批准,涵盖实体肿瘤和血液肿瘤,其中包括国内首个获批的JAK2-V617F突变检测试剂盒及用于免疫治疗的PDL-1检测试剂盒;以及8款CE认证产品。同时,迈杰医学有40多款在研 CDx/IVD产品管线其中有10个正在临床试验中。基于独创的一体化商业模式,迈杰医学已迅速发展成为中国伴随诊断整体解决方案创新企业,解决创新药物的研发痛点及患者的用药痛点,助力精准医疗。






 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发