生物医学“基本法”出炉,中国细胞与基因治疗新时代序幕拉开!
| 导读 | 《生物医学新技术临床研究和临床转化应用管理条例》完整权威政策解读 |
2025年10月10号,国务院总理李强日前签署国务院令,公布《生物医学新技术临床研究和临床转化应用管理条例》(以下简称《条例》),自2026年5月1日起施行。《条例》旨在规范生物医学新技术临床研究和临床转化应用,促进医学科学技术进步和创新,保障医疗质量安全,维护人的尊严和健康。
此次《条例》的颁布作为重大行业政策支撑及利好,标志着中国在基因编辑、干细胞、体细胞治疗技术等前沿生物医学新技术领域,从过去相对模糊的监管状态,迈向了权责清晰、路径明确的规范化发展新阶段 ;同时规范了生物医学新技术临床研究与转化应用的要求和流程,对临床研究机构、生物技术企业及整个产业生态的深远影响,以制度保障促进医学进步,推动医疗技术创新及行业高质量发展。菲鹏对文件内容第一时间予以深度解读。


长期以来,以基因治疗、细胞治疗等前沿疗法为代表的医学技术面临着“创新走不出去”的困境,其中核心痛点在于“身份不明”及“路径模糊”。一方面,在细胞与基因治疗(CGT)领域双轨制的监管范畴下,技术轨开发路径由于定义不清无法真正独立运行;另一方面,概念不清导致不同地域监管部门、企业及研究机构对概念把握标准的差异使得行业长期处于监管难度大、鱼龙混杂的局面。
国家卫健委于2018年出台的《医疗技术临床应用管理办法》就医疗技术的临床应用作出具体的规定。根据《医疗技术临床应用管理办法》,医疗技术被定义为“医疗机构及其医务人员以诊断和治疗疾病为目的,对疾病作出判断和消除疾病、缓解病情、减轻痛苦、改善功能、延长生命、帮助患者恢复健康而采取的医学专业手段和措施”。
在此基础上,《条例》定义了生物医学新技术存在“生物医学”和“新技术”等方面的特殊因素,明确的定义为企业后续的产品开发及临床应用提供了清晰的边界。这一清晰的界定,为菲鹏等早在CGT领域深度布局的企业提供了明确的发展预期。以其旗下MOTE Therapeutics(简称MOTE)所专注的核酸药物创新靶向递送技术为例,正好落在这一监管范畴内,迎来了明确的政策环境。
2.建立明确的临床前-临床研究-应用转化的衔接路径及商业化出口
政策整体通过清晰且明确的监管路径指引生物医学新技术从临床前-临床研究-应用转化完整且明确的路径:
临床前-临床研究:经临床前研究证明安全、有效的生物医学新技术,方可获准开展临床研究,这一过程始于对技术“充足科学依据”的严格要求,旨在确保任何在人体上进行的试验都具备坚实的科学基础和初步的安全数据。同时从征求意见稿的审批机制重新规定延续当前的备案制也体现监管部门对于提升专业性技术审核效率的充分考量。
临床研究-应用转化:临床研究证明安全、有效、符合伦理的生物医学新技术,经国务院卫生主管部门审查批准后,可以转化应用于临床。同时参考之前干细胞管理条例转化应用相关规定,干细胞制剂完成临床研究后,可将研究结果作为技术性申报资料提交,用于申请药品注册临床试验。这为干细胞技术从实验室走向临床应用提供了清晰路径,缩短了研发到上市的时间周期,加速创新成果的转化。生物医学新技术的临床研究数据作为后续药品申报材料在具有相关实践基础上也同样“未来可期”。
同时从商业路径上完成应用转化意味着在临床端能够获取明确的收费标准:《条例》第20条明确临床研究发起机构及研究机构不得向受试者收取与生物医学新技术临床研究有关的费用。在其批准进入临床应用后明确可以收取费用。
3.明确的准入标准进一步规范行业发展
开展生物医学新技术临床研究具有明确的开展门槛,将进一步出清不合规机构,保证产业在科学性和规范性基础上良性发展,资源也能够集中在真正有高质量研究能力的头部机构和专家。
机构资质:必须是三级甲等医院。有符合要求的临床研究学术委员会和伦理委员会,同时资金来源明确;这一规定确保了研究活动必须在具备雄厚医疗实力、完善的应急处理能力和高质量管理体系的机构中进行。
临床研究者资质:具备执业医师资格和高级职称,且拥有良好的科研信誉。
4.CGT领域‘双轨制’管理模式下技术轨具备独立发展广阔空间
生物医学新技术和先进治疗药品是中国监管体系下针对CGT等前沿领域两个既紧密关联又存在本质区别的术语,同时也是双轨制管理下相互衔接但又有所区分的发展路径(技术轨&药品轨) 。
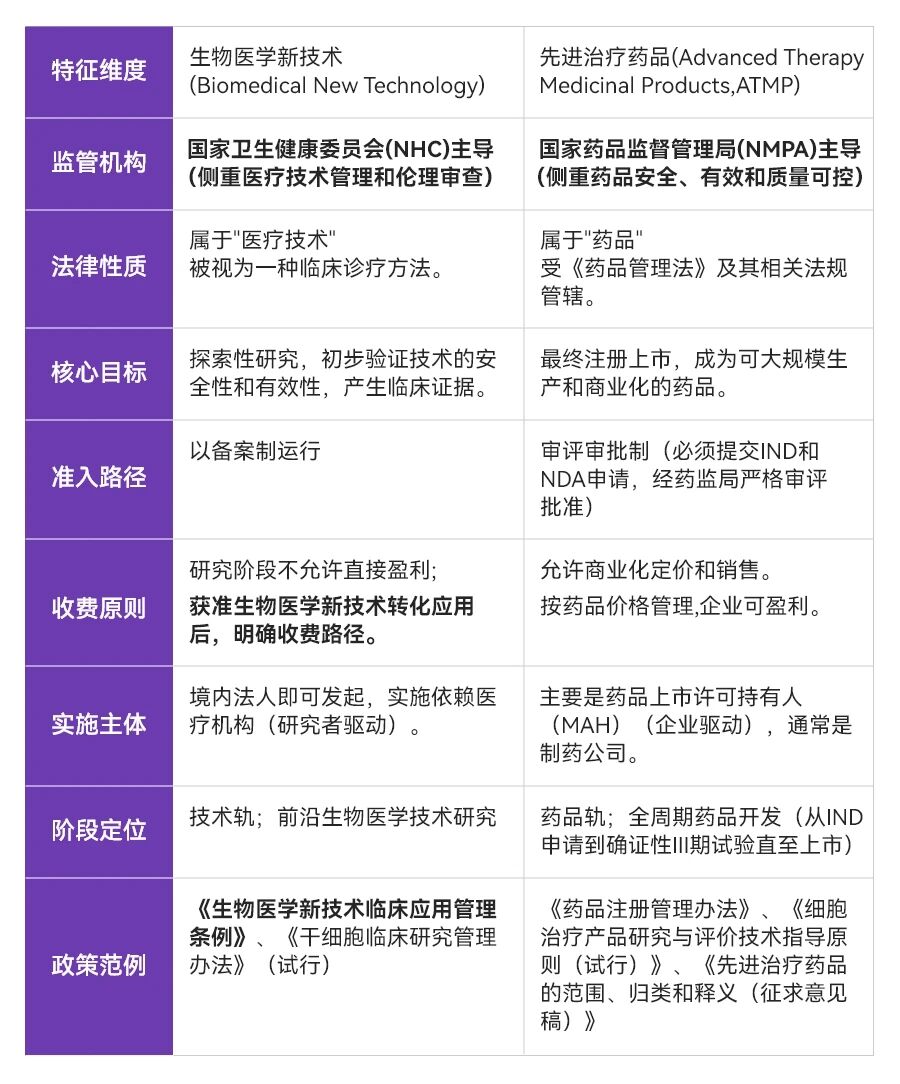 既往相较于药品轨完善的定义规范、开发流程以及监管审批标准,技术轨往往落入为之服务的附属角色;伴随着《条例》的出具及法规完善,技术轨监管支持下同样建立了合规清晰的早研-临床研究-转化应用商业化的闭环结构。双轨制的独立并行发展为企业策略上带来了更加丰富的选择,进一步激活创新型企业的活力和行业创造性。
既往相较于药品轨完善的定义规范、开发流程以及监管审批标准,技术轨往往落入为之服务的附属角色;伴随着《条例》的出具及法规完善,技术轨监管支持下同样建立了合规清晰的早研-临床研究-转化应用商业化的闭环结构。双轨制的独立并行发展为企业策略上带来了更加丰富的选择,进一步激活创新型企业的活力和行业创造性。
菲鹏一直致力于诊疗前沿技术与解决方案的探索,由菲鹏和Robert Alexander Wesselhoeft(Alex)博士共同创立的MOTE Therapeutics(简称MOTE)是一家专注于核酸药物创新靶向递送技术和应用产品研发的创新公司,成立至今已在中美两地分别组建了高度创新的核心研发团队,搭建了全球领先的环状RNA平台以及通用型靶向递送平台。其中,核心技术平台MOBILIZE采用非化学偶联方式进行LNP的靶向修饰,可实现细胞水平的高效主动靶向递送,且可兼容不同cargo、不同LNP、不同binder,拓展性极强。
MOBILIZE解决了目前行业中靶向LNP技术面临的靶向特异性不足、制造工艺复杂以及递送效率不高等关键难题,远优于目前行业中其他靶向递送技术,是领域内最具差异化和领先性的靶向递送平台。当前CGT领域正在处于由体外疗法快步迈入体内疗法的关键时期,而MOBILIZE凭借安全、高效、精准的靶向递送特性,必然能在这一过程中拓展出无限的应用前景。
凭借世界级的科学实力、颠覆性的递送技术引擎,以及拓展RNA疗法技术边界的使命感,MOTE将致力于引领靶向递送领域、开拓全新治疗范式。MOTE目前正面向全球寻求合作伙伴,共同推进临床前研究及更好疾病治疗方案的打造。
总体而言,此次法规的完善为真正具有创新价值的技术提供一个合法、清晰的“身份”和发展路径,打通从基础研究到临床应用的转化链条。明确的法规路径将极大增强投资人的信心,资本将更加青睐那些拥有真正“硬科技”、扎实临床前研究数据和强大合规能力的团队,行业将回归技术和价值本身。另一方面,合规框架的清晰化,也意味着探索性临床研究的风险被更精确地定义和管理,试错成本和时间将大大缩短。以政策为锚驱动中国CGT产业蓬勃繁荣。
如您对菲鹏旗下MOBILIZE技术平台感兴趣,欢迎通过以下方式联系。
邮箱:BD@motetx.com (BD)
电话:13668139169(BD);15001241518(融资)
信息来源:
中华人民共和国国家卫生健康委员会 关于生物医学新技术临床应用管理条例(征求意见稿)公开征求意见的公告https://www.nhc.gov.cn/wjw/yjzj/201902/e2d873b36ddf41a28b2cf967d14d074c.shtml
李强签署国务院令 公布《生物医学新技术临床研究和临床转化应用管理条例》https://www.gov.cn/yaowen/liebiao/202510/content_7043798.htm
此次《条例》的颁布作为重大行业政策支撑及利好,标志着中国在基因编辑、干细胞、体细胞治疗技术等前沿生物医学新技术领域,从过去相对模糊的监管状态,迈向了权责清晰、路径明确的规范化发展新阶段 ;同时规范了生物医学新技术临床研究与转化应用的要求和流程,对临床研究机构、生物技术企业及整个产业生态的深远影响,以制度保障促进医学进步,推动医疗技术创新及行业高质量发展。菲鹏对文件内容第一时间予以深度解读。

政策历史沿革
根据公开信息,此次李强总理签署国务院令公布的《条例》,相关部委已经过历时六年准备:国家卫健委在2019年2月发布并公开征求意见的《生物医学新技术临床应用管理条例(征求意见稿)》(以下简称“《征求意见稿》”);同年9月在多个高校网站公布了《生物医学新技术临床研究和临床转化应用管理条例(草案)》扫描版文件(和本次审议通过文件同名,以下简称“《条例扫描版》");后几经沉寂,在年初公布的最新《国务院2025年度立法工作计划》中,《生物医学新技术临床研究与转化应用管理条例》已被列为拟制定或修改的行政法规之一。2025年9月12日的国务院常务会议上,会议审议通过《生物医学新技术临床研究和临床转化应用管理条例(草案)》。
政策内容对比分析
结合官方发布的两份公开文件(《条例》及《征求意见稿》),笔者对其中部分关键内容予以对比及解读,以求探寻监管机构释放的监管思路:(不同颜色指代:紫色--明显差异的;红色--新增内容)
正式稿相较于征求意见稿突出体现了监管的科学性和高效性,后续需关注卫健委的配套实施文件,期待具体实施标准&细则。
政策内容关键价值解析
1.明确生物医学新技术定义,提供清晰的应用管理边界长期以来,以基因治疗、细胞治疗等前沿疗法为代表的医学技术面临着“创新走不出去”的困境,其中核心痛点在于“身份不明”及“路径模糊”。一方面,在细胞与基因治疗(CGT)领域双轨制的监管范畴下,技术轨开发路径由于定义不清无法真正独立运行;另一方面,概念不清导致不同地域监管部门、企业及研究机构对概念把握标准的差异使得行业长期处于监管难度大、鱼龙混杂的局面。
国家卫健委于2018年出台的《医疗技术临床应用管理办法》就医疗技术的临床应用作出具体的规定。根据《医疗技术临床应用管理办法》,医疗技术被定义为“医疗机构及其医务人员以诊断和治疗疾病为目的,对疾病作出判断和消除疾病、缓解病情、减轻痛苦、改善功能、延长生命、帮助患者恢复健康而采取的医学专业手段和措施”。
在此基础上,《条例》定义了生物医学新技术存在“生物医学”和“新技术”等方面的特殊因素,明确的定义为企业后续的产品开发及临床应用提供了清晰的边界。这一清晰的界定,为菲鹏等早在CGT领域深度布局的企业提供了明确的发展预期。以其旗下MOTE Therapeutics(简称MOTE)所专注的核酸药物创新靶向递送技术为例,正好落在这一监管范畴内,迎来了明确的政策环境。
2.建立明确的临床前-临床研究-应用转化的衔接路径及商业化出口
政策整体通过清晰且明确的监管路径指引生物医学新技术从临床前-临床研究-应用转化完整且明确的路径:
临床前-临床研究:经临床前研究证明安全、有效的生物医学新技术,方可获准开展临床研究,这一过程始于对技术“充足科学依据”的严格要求,旨在确保任何在人体上进行的试验都具备坚实的科学基础和初步的安全数据。同时从征求意见稿的审批机制重新规定延续当前的备案制也体现监管部门对于提升专业性技术审核效率的充分考量。
临床研究-应用转化:临床研究证明安全、有效、符合伦理的生物医学新技术,经国务院卫生主管部门审查批准后,可以转化应用于临床。同时参考之前干细胞管理条例转化应用相关规定,干细胞制剂完成临床研究后,可将研究结果作为技术性申报资料提交,用于申请药品注册临床试验。这为干细胞技术从实验室走向临床应用提供了清晰路径,缩短了研发到上市的时间周期,加速创新成果的转化。生物医学新技术的临床研究数据作为后续药品申报材料在具有相关实践基础上也同样“未来可期”。
同时从商业路径上完成应用转化意味着在临床端能够获取明确的收费标准:《条例》第20条明确临床研究发起机构及研究机构不得向受试者收取与生物医学新技术临床研究有关的费用。在其批准进入临床应用后明确可以收取费用。
3.明确的准入标准进一步规范行业发展
开展生物医学新技术临床研究具有明确的开展门槛,将进一步出清不合规机构,保证产业在科学性和规范性基础上良性发展,资源也能够集中在真正有高质量研究能力的头部机构和专家。
机构资质:必须是三级甲等医院。有符合要求的临床研究学术委员会和伦理委员会,同时资金来源明确;这一规定确保了研究活动必须在具备雄厚医疗实力、完善的应急处理能力和高质量管理体系的机构中进行。
临床研究者资质:具备执业医师资格和高级职称,且拥有良好的科研信誉。
4.CGT领域‘双轨制’管理模式下技术轨具备独立发展广阔空间
生物医学新技术和先进治疗药品是中国监管体系下针对CGT等前沿领域两个既紧密关联又存在本质区别的术语,同时也是双轨制管理下相互衔接但又有所区分的发展路径(技术轨&药品轨) 。

前瞻布局:菲鹏深度卡位CGT关键底层技术
在政策利好的大背景下,菲鹏等企业前瞻性布局带来的技术红利正在政策加持下加速转化为发展优势。菲鹏一直致力于诊疗前沿技术与解决方案的探索,由菲鹏和Robert Alexander Wesselhoeft(Alex)博士共同创立的MOTE Therapeutics(简称MOTE)是一家专注于核酸药物创新靶向递送技术和应用产品研发的创新公司,成立至今已在中美两地分别组建了高度创新的核心研发团队,搭建了全球领先的环状RNA平台以及通用型靶向递送平台。其中,核心技术平台MOBILIZE采用非化学偶联方式进行LNP的靶向修饰,可实现细胞水平的高效主动靶向递送,且可兼容不同cargo、不同LNP、不同binder,拓展性极强。
MOBILIZE解决了目前行业中靶向LNP技术面临的靶向特异性不足、制造工艺复杂以及递送效率不高等关键难题,远优于目前行业中其他靶向递送技术,是领域内最具差异化和领先性的靶向递送平台。当前CGT领域正在处于由体外疗法快步迈入体内疗法的关键时期,而MOBILIZE凭借安全、高效、精准的靶向递送特性,必然能在这一过程中拓展出无限的应用前景。
凭借世界级的科学实力、颠覆性的递送技术引擎,以及拓展RNA疗法技术边界的使命感,MOTE将致力于引领靶向递送领域、开拓全新治疗范式。MOTE目前正面向全球寻求合作伙伴,共同推进临床前研究及更好疾病治疗方案的打造。
总体而言,此次法规的完善为真正具有创新价值的技术提供一个合法、清晰的“身份”和发展路径,打通从基础研究到临床应用的转化链条。明确的法规路径将极大增强投资人的信心,资本将更加青睐那些拥有真正“硬科技”、扎实临床前研究数据和强大合规能力的团队,行业将回归技术和价值本身。另一方面,合规框架的清晰化,也意味着探索性临床研究的风险被更精确地定义和管理,试错成本和时间将大大缩短。以政策为锚驱动中国CGT产业蓬勃繁荣。
如您对菲鹏旗下MOBILIZE技术平台感兴趣,欢迎通过以下方式联系。
邮箱:BD@motetx.com (BD)
电话:13668139169(BD);15001241518(融资)
信息来源:
中华人民共和国国家卫生健康委员会 关于生物医学新技术临床应用管理条例(征求意见稿)公开征求意见的公告https://www.nhc.gov.cn/wjw/yjzj/201902/e2d873b36ddf41a28b2cf967d14d074c.shtml
李强签署国务院令 公布《生物医学新技术临床研究和临床转化应用管理条例》https://www.gov.cn/yaowen/liebiao/202510/content_7043798.htm
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发