【Nature子刊】肿瘤边界的免疫学:中山大学张荣欣团队解析结直肠癌治疗的新机制
| 导读 | 团队整合了空间增强分辨率omics-测序(Stereo-seq)、单细胞RNA测序和多路复用成像分析,绘制了未经治疗和接受过ICB治疗的CRC患者肿瘤的高清空间图。 |
2024年11月26日,中山大学肿瘤防治中心结直肠科张荣欣教授团队在期刊《Nature Communications》上发表了题为“Spatially organized tumor-stroma boundary determines the efficacy of immunotherapy in colorectal cancer patients”的研究论文。研究结果表明,肿瘤-基质边界的空间组织和免疫状态是dMMR和pMMR CRC的一个显著特征,与ICB反应有关。这项研究指出了肿瘤的分子和细胞空间结构在ICB反应中的重要性,提出了重新规划肿瘤-基质边界,以提高大多数CRCs免疫疗法敏感性的可能性。

https://www.nature.com/articles/s41467-024-54710-3
关于结直肠癌
01
免疫检查点阻断(ICB)疗法重新定义了结直肠癌(CRC)患者的治疗。一般来说,DNA错配修复(MMR)缺陷/微卫星不稳定性高(dMMR/MSI-hi)的结直肠癌患者突变负荷较高,往往对ICB疗法敏感,而MMR强化(pMMR)的患者突变负荷通常较低,大多无应答。团队最近报告了在dMMR队列中,抗程序死亡1(PD1)单克隆抗体(mAb,sintilimab)的总体反应率为93.75%(15/16)(12例为完全反应),这有可能使这些患者免于根治性手术。
在这项研究中,团队通过分析25例CRC患者的肿瘤标本,其中包括未经治疗的dMMR、pMMR和抗PD1治疗的dMMR患者,应答者(完全应答 (CR)/PR)和非应答者(疾病稳定,SD),生成了CRC空间转录组图谱,并发现了一个300微米(μm)的边界区域,该区域调控免疫细胞流入肿瘤中心区域(>150μm)。在这种肿瘤-基质边界的微观结构中,肿瘤细胞、成纤维细胞、巨噬细胞/树突状细胞(DC)和T细胞亚群之间的相互作用,与dMMR和pMMR CRCs患者不同的免疫状态有关,这可能与他们不同的ICB反应有关。
CXCL14CAFs可能有助于ICB非应答者TME中的有序基质结构和T细胞排异
02
CXCL14CAF可能通过重塑细胞外基质的组织和结构来促进结构屏障的形成,从而导致ICB非应答者的T细胞专属TME。通过使用有转录组学和临床数据的独立ICB治疗的CRC患者队列(GSE205506),团队进一步观察到,与应答者相比,ICB非应答者的CAF中CXCL14表达量和ECM组织特征得分显著更高。在肾细胞癌(RCC,SCP1288)和黑色素瘤(GSE115978)患者的ICB非应答者中,也发现了一致的较高CXCL14表达。这些结果表明,CXCL14在ICB耐药性中发挥了重要作用,支持靶向CXCL14CAFs以破坏肿瘤-基质边界的结构屏障,可能会提高ICB对大多数pMMR CRCs的疗效。
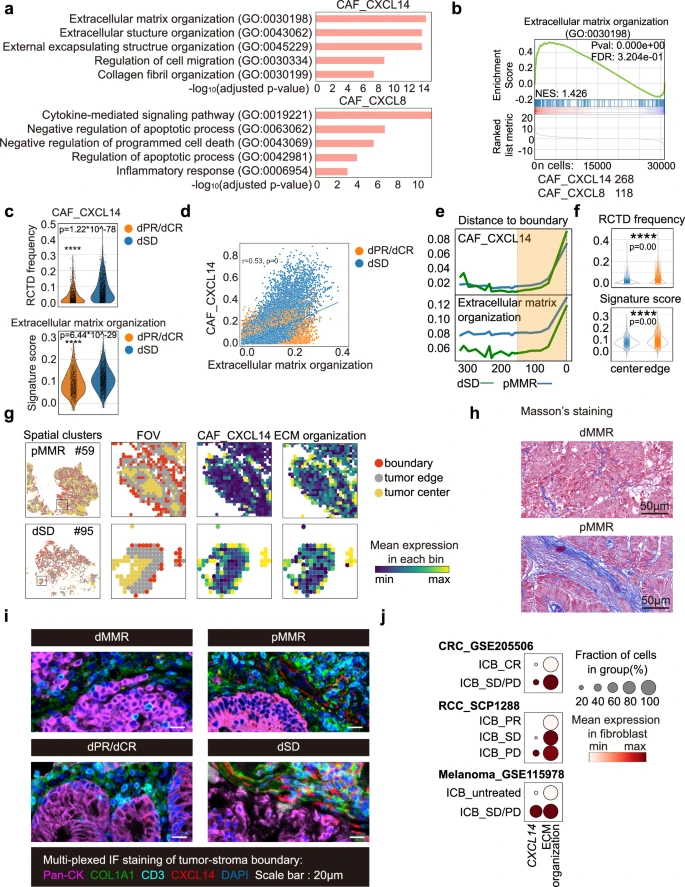
CXCL14CAFs可能是导致ICB无应答者TME中基质结构紊乱和T细胞被排斥的原因。
肿瘤细胞可能通过IHH/PTCH1轴促进CXCL14CAFs,从而制约ICB对pMMR CRC患者的疗效
03
与dMMR CRC细胞系(包括HCT116、HCT8和HCT1549)相比,团队观察到pMMR CRC细胞系HT29和SW620中IHH的表达更高。用IHH重组蛋白(Glpbio,5μg/mL)处理CXCL14CAFs,会导致MMP11释放量显著增加。此外,将CXCL14CAFs暴露于pMMR CRC HT29细胞的条件培养基(CM),也会导致类似的MMP11上调。重要的是,这种上调可被IHH inbitior Vismodegib(Selleckchem,25µM)抑制。这些结果表明,pMMR肿瘤细胞与CAF_CXCL14之间可能通过IHH_PTCH1轴相互作用。
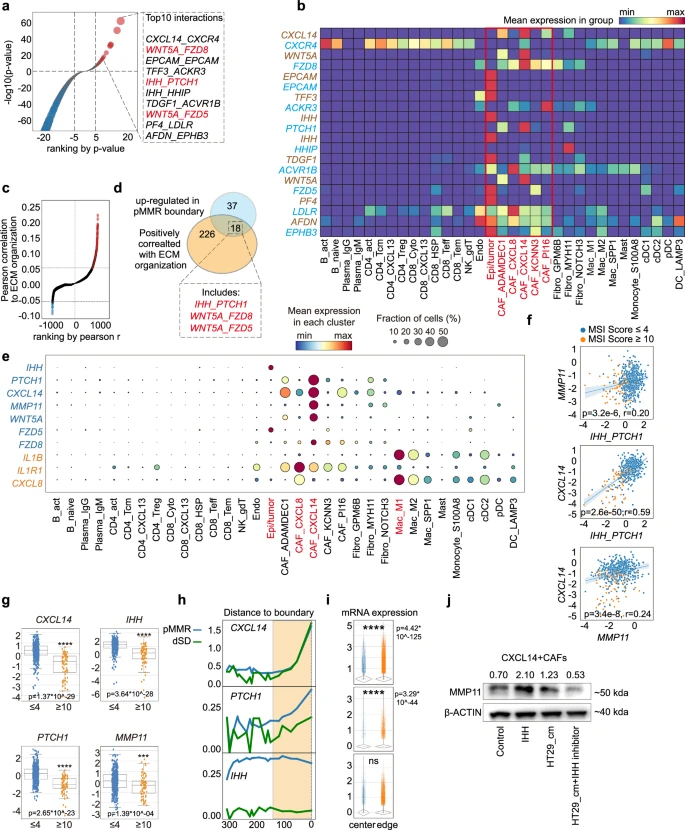
肿瘤细胞通过IHH/PTCH1轴促进CXCL14CAFs,制约了ICB对pMMR CRC患者的疗效。
总结
04
1. 细胞-细胞相互作用:细胞-细胞相互作用在形成协调的多细胞肿瘤-基质边界(0±150µm)中起作用,这可能有助于ICB反应。
2. LAMP3DCs和CXCL13T细胞的作用:LAMP3DCs和CXCL13T细胞的空间分布和调控格局在形成ICB反应者的肿瘤-基质边界方面,具有重要作用。
3. 肿瘤细胞与CXCL14CAF的相互作用:这种相互作用可能导致免疫排斥和对ICB不敏感的TME的形成。
4. TME空间结构的重要性:研究强调了TME空间结构,特别是肿瘤-基质边界对ICB疗效的影响,并指出在pMMR CRCs中通过靶向CXCL14CAFs,来敏化ICB反应的潜力。
5. 免疫细胞的空间分布:免疫细胞的空间分布(而非丰度)可区分对ICB敏感和不敏感的CRC患者的TME。
6. 肿瘤-基质边界的免疫状态:肿瘤-基质边界的独特免疫状态与ICB治疗的临床结果有关。
7. CXCL13对TLS形成的重要性:CXCL13对肿瘤特异性淋巴结构(TLS)的形成至关重要,与多种癌症的ICB治疗效果相关。
8. pMMR CRC对ICB不敏感的机制:由ECM组织失调引起的结构屏障,导致了免疫流入的中断和免疫排斥TME的形成,这可能是pMMR CRC中ICB低反应的原因。
9. 靶向治疗的潜力:研究提供了靶向治疗ICB不敏感的TME形成背后的肿瘤-基质边界的丰富数据集。
10. 未来研究方向:需要在临床前和临床试验中开展更多工作,以评估通过重塑ICB无应答者的TME空间结构,来增敏ICB治疗的潜力。
参考资料:
1.Arora, S. et al. Existing and emerging biomarkers for immune checkpoint immunotherapy in solid tumors. Adv. Ther. 36, 2638–2678 (2019).
2.André, T. et al. Pembrolizumab in microsatellite-instability–high advanced colorectal cancer. N. Engl. J. Med. 383, 2207–2218 (2020).
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发