显著抑制肿瘤生长!中山大学合作发文:发现肝癌靶向治疗新策略
| 导读 | 癌旁肝细胞是肝癌微环境的重要组成部分,然而,癌旁肝细胞在局部肿瘤免疫界面中的作用及其潜在的分子机制尚未阐明。 |
9月6日,中山大学与澳门大学研究人员合作在期刊《Molecular Cancer》上发表了研究论文,题为“YTHDF2 in peritumoral hepatocytes mediates chemotherapy-induced antitumor immune responses through CX3CL1-mediated CD8+ T cell recruitment”,本研究表明,奥沙利铂(OXA)上调肝细胞中m6A修饰和YTHDF2的表达。使用荷瘤肝脏特异性YTHDF2敲除小鼠的研究表明,肝细胞Ythdf2通过CD8+ T细胞募集和活化抑制肝脏肿瘤生长。此外,YTHDF2介导了对免疫治疗的应答。机制上,OXA通过激活cGAS-STING信号通路上调YTHDF2的表达,从而增强免疫治疗干预的疗效。Ythdf2以m6a依赖方式稳定Cx3cl1转录,调控CD8+ T细胞之间的相互作用与肝脏恶性肿瘤的进展。因此,本研究阐明了肝细胞YTHDF2的新作用,它促进了治疗诱导的肝脏抗肿瘤免疫反应。本研究的发现为靶向YTHDF2的治疗获益机制提供了有价值的见解。

https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02097-6#Sec7
背景知识
01
肝癌是世界范围内流行的恶性肿瘤,是癌症相关死亡率的第三大常见原因。除肝脏原发恶性肿瘤外,肝脏也易被不同器官部位的转移病灶定植(尤其是结肠癌),据报道,一半的结直肠癌患者在初诊时就伴有肝转移,最终因肝内肿瘤进展而死亡。近年来的研究表明,肝细胞作为肝脏肿瘤微环境(TME)的重要组成部分,与肝癌的发生、发展相关。然而,肝细胞在肝脏恶性肿瘤中的功能作用和临床重要性尚未被研究。肝细胞与免疫细胞共同形成TME,肿瘤的发生与淋巴细胞的募集有关。然而,肝细胞、淋巴细胞和癌细胞之间的相互作用尚不清楚。因此,迫切需要阐明肝癌进展的分子机制,以开发新的治疗策略。
n6 -甲基腺苷(m6A)甲基化是一种常见的表观遗传RNA修饰,可调控多种分子和细胞过程,调节肿瘤浸润淋巴细胞(TILs)的浸润和活化。此外,化疗药物还可通过诱导免疫原性改变等多种机制调控肿瘤细胞RNA m6A修饰,抑制肿瘤进展和免疫逃逸。以奥沙利铂(OXA)为基础的化疗已被用作肝癌和结直肠癌(CRC)的标准治疗模式。多项研究表明,以奥沙利铂为基础的化疗联合免疫治疗可延长晚期肝细胞癌(HCC)和CRC患者的生存期。化疗通过诱导免疫原性细胞死亡和破坏肿瘤细胞的免疫逃逸来诱导抗肿瘤免疫应答。奥沙利铂联合免疫治疗后调节肝脏免疫微环境和增强肿瘤应答的机制尚未阐明。
YTHDF2缺陷肝细胞通过损害CD8+ T细胞抗肿瘤反应促进OXA应激条件下的肝脏肿瘤生长
02
研究人员使用肝脏特异性YTHDF2 KO小鼠品系检测了YTHDF2在肝肿瘤发展和化疗过程中肝细胞中的作用。在Ythdf2F/F和Ythdf2LKO同窝小鼠原位肝内注射Hepa1-6(小鼠肝癌细胞株)或脾内注射MC38(小鼠结直肠癌细胞株)后第14天,Ythdf2LKO小鼠的肝脏肿瘤负荷(定义为总肝重量/体重比)高于Ythdf2F/F小鼠,但差异无统计学意义。但经过OXA预刺激后,Ythdf2LKO小鼠的肿瘤负荷显著高于Ythdf2F/F小鼠。这些结果表明,肝细胞中的YTHDF2缺陷使暴露于oxa的肝脏重编程为支持肿瘤的生态系统。
接下来,研究人员对经OXA预处理并原位注射Hepa1-6细胞的Ythdf2F/F和Ythdf2LKO小鼠的瘤旁组织进行RNA测序。YTHDF2缺陷导致多个基因表达失调(96个上调基因和560个下调基因)。研究人员还观察到Ythdf2LKO小鼠肝脏中肿瘤浸润性IFNγ+、TNFα+、GzmB+ CD8+ T细胞百分比降低,而TIM3+ PD1+ CD8+ T细胞百分比升高,这与肿瘤负荷增强一致。此外,当Ythdf2LKO小鼠接受腹腔注射CD8抗体,诱导CD8+ T细胞的全身性清除时,Ythdf2LKO小鼠中降低的抗肿瘤反应被完全消除。另外,在年龄和性别匹配的Ythdf2F/F和Ythdf2LKO小鼠中,肝脏和脾脏中naïve免疫细胞的组成和频率相似。而且,Ythdf2F/F和Ythdf2LKO小鼠具有相似的肿瘤浸润B细胞、自然杀伤细胞、γδ T细胞、CD4+ T细胞、巨噬细胞、中性粒细胞、单核细胞和DCs的百分比和绝对数量。此外,研究人员通过qPCR评估了Ythdf2F/F和Ythdf2LKO小鼠肿瘤组织中T细胞炎症基因的表达谱,观察到Ythdf2LKO小鼠中大多数基因的表达降低。这些结果表明,肝脏YTHDF2保持了肝脏微环境的免疫平衡,并且肝细胞中YTHDF2的下调导致CD8+ T细胞功能障碍。因此,肝细胞中的YTHDF2缺陷以CD8+ T细胞依赖的方式促进化疗后的肝肿瘤生长。
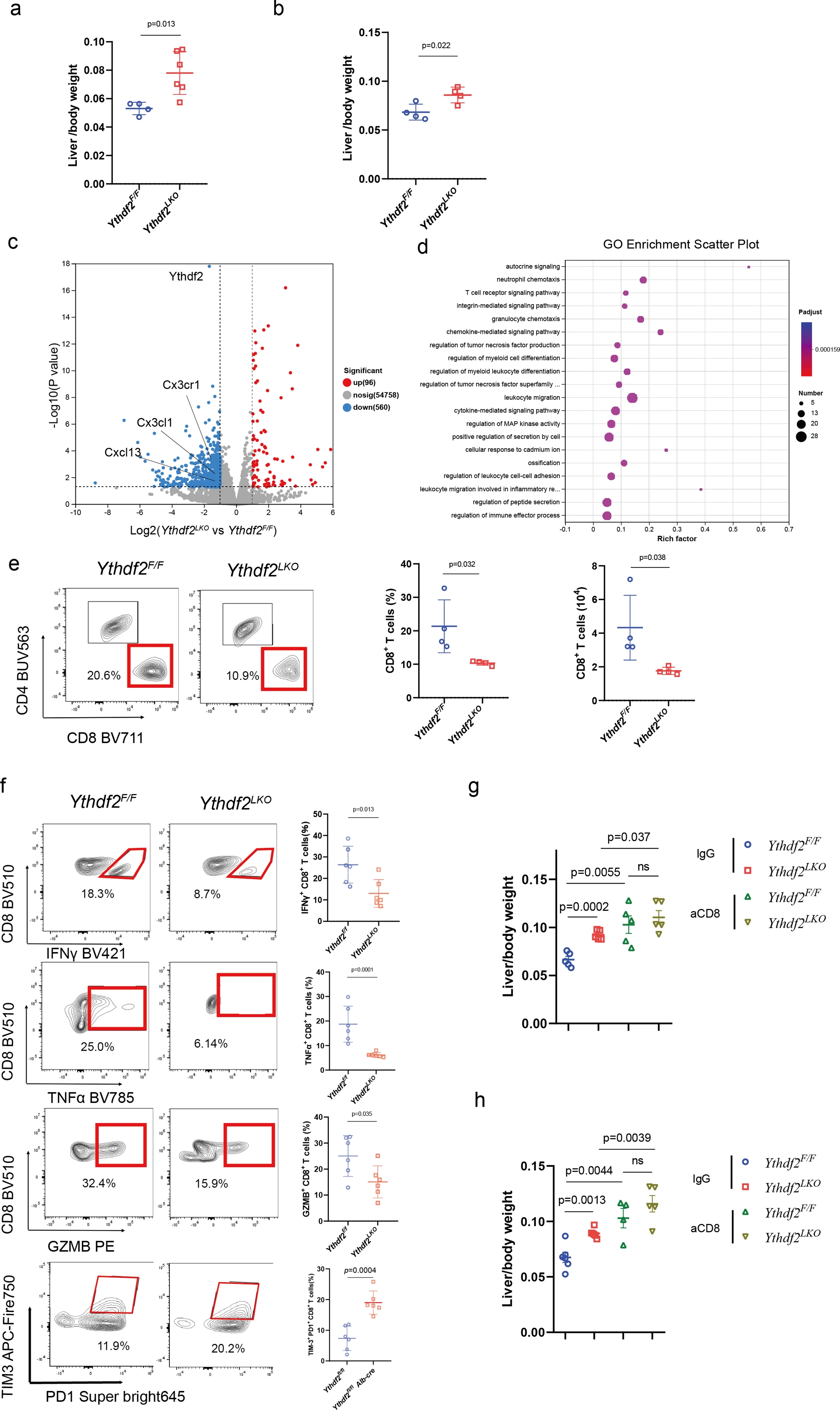
YTHDF2缺陷肝细胞通过损害CD8+ T细胞抗肿瘤反应促进OXA应激条件下的肝脏肿瘤生长
肝细胞YTHDF2-CX3CL1轴增强免疫治疗的抗肿瘤疗效
03
研究人员通过免疫组织化学染色验证CX3CL1在HAIC患者癌旁组织中的表达上调和CD8+ T细胞浸润。相关性分析显示,YTHDF2与CX3CL1、CD8+ T细胞在研究队列中均呈正相关。研究人员使用癌症基因组图谱-肝细胞癌队列验证了YTHDF2、CX3CL1和CD8+ T细胞的相关性分析结果。肝细胞YTHDF2-CX3CL1轴与CD8+ T细胞呈正相关。研究人员探讨了YTHDF2-CX3CL1轴是否与免疫治疗的疗效相关。肝脏肿瘤的Ythdf2F/F小鼠对OXA或抗pd1抗体单药治疗表现出耐药。而联合应用OXA和抗pd1抗体可显著降低肿瘤负荷。相反,联合治疗的效果在Ythdf2LKO小鼠中减弱,表明化疗和免疫治疗对肝癌的协同治疗作用依赖于肝脏YTHDF2的表达。研究人员使用免疫组织化学染色检测了CD8+ T细胞浸润情况,Ythdf2F/F联合治疗组小鼠CD8+ T细胞浸润数量最多,Ythdf2LKO组小鼠CD8+ T细胞浸润数量较少。研究人员发现在接受HAIC和抗pd1抗体治疗的患者中,癌旁组织中YTHDF2的上调与改善预后相关。这些结果表明,肝细胞中的YTHDF2-CX3CL1轴增强了免疫治疗的抗肿瘤疗效。
研究小结
04
本研究表明YTHDF2表达是OXA和免疫治疗联合疗效的关键决定因素,为提高OXA治疗获益提供了机制基础。另外,最近关于RNA修饰的研究强调了靶向m6A修饰剂(如METTL3、FTO和ALKBH5)的小分子抑制剂在癌症治疗中的潜在效用。最近的一项研究还表明,使用Sirna靶向巨噬细胞中的YTHDF2显著抑制肿瘤生长。本研究提示靶向肝细胞YTHDF2-CX3CL1轴联合免疫治疗是一种潜在的肝癌治疗策略。(转化医学网360zhyx.com)
【参考资料】
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02097-6#Sec7
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发