Nature Communications|OGM为基因编辑保驾护航,让脱靶无所遁行
| 导读 | 随着业界对基因编辑工具的边界不断探索,对基因编辑药物安全性意识的提高,以及法规政策的不断完善细化,OGM技术以其结构变异检测的卓越表现,将有望成为常规的质控工具,为基因编辑保驾护航 |

2023年8月25日,中国台湾林口长庚医院干细胞与转译癌症研究所和美国加州大学旧金山分校等多个研究机构在Nature Communications上发表一项合作研究,通过Bionano OGM(optical genome mapping,全基因组光学图谱)技术检测CRISPR-Cas9编辑后的人诱导多能干细胞(iPSC)系,评估其基因组完整性,并揭示了可能制约经基因编辑技术改造的细胞药物应用于临床的基因组结构变异和安全隐患。研究者发现,大约15%(13个基因组中的2个)CRISPR-Cas9基因编辑后的细胞克隆中发生了未能预测的基因组结构变异事件,在靶位点外存在非预期的致病性大片段染色体缺失。除了这两个非靶位点的缺失外,作者还报告了靶位点上的一个大片段缺失,也是意外事件。
研究者认为,作为遗传病和癌症的下一代疗法,基因编辑和细胞治疗一直被寄予众望;更全面的全基因组变异谱分析可能是一种有价值的安全性评估策略,以明确基因组编辑后的完整性,最大限度地减少临床研究中的意外风险。
基因编辑和脱靶
基因编辑技术通过修饰基因组中的目标基因,实现目标DNA的精准改造,是一项彻底改变生物医学时代的技术。其中, CRISPR-Cas9基因编辑系统正成为临床转化特别是基因治疗研究的代表性技术,Emmanuelle Charpentier和Jennifer a . Doudna也因此被授予2020年诺贝尔化学奖。自2012年问世以来,学术界对CRISPR/Cas9对人类疾病尤其是遗传性疾病从根本上治愈寄予厚望,但同时其脱靶效应导致的潜在致癌风险也一直备受关注,也是其未来广泛应用的最大障碍之一。
脱靶是指基因编辑工具在目标基因以外的位置进行修剪、复制或插入,导致非特异性遗传修饰,包括非靶基因的点突变、缺失、插入、倒位和易位等基因组变异,这些意外变异可能导致基因组不稳定并破坏正常基因的功能,甚至有致癌风险。
在经典的CRISPR/Cas9编辑中,sgRNA引导Cas9酶结合到特定位点进行切割。一般来说,sgRNA识别序列约为20 bp,但Cas9允许在一定的容错率内进行错配切割,例如,在目标序列外形成突变,或者sgRNA设计中的高GC含量导致碱基不匹配或偏离目标的编辑。同时,研究表明,使用质粒传递Cas9蛋白和sgRNA将导致长时间表达,又将大大增加脱靶的风险。
为什么要检测脱靶?
科学性
CRISPR-Cas9在基因组可能造成两种意外变异:1)在除靶位点以外的位置引起的意外突变,这种脱靶突变可能会破坏非靶向基因的功能或异常调控,因此可能会造成严重后果;2)在预期的靶位点发生的更大的基因组结构变化和片段丢失。
先前的研究中有关脱靶的报道屡见不鲜,包括人类和小鼠细胞系中高频脱靶和引入结构变异1,2,3,4,在小鼠胚胎中一个脱靶位点发生了三次错配的高频突变5,在编辑受精的斑马鱼卵后发现意外的结构变异(SV)出现在靶位点上和靶位点外,并可以传递给子代——成年祖师斑马鱼的生殖细胞呈嵌合变异,26%的后代携带脱靶突变,9%携带结构变异6。然而目前的变异风险评估通常仅针靶位点和经预测的潜在脱靶位点(sgRNA序列相近区域);对于更大范围的结构变异检测仍受到检测手段的制约, 例如核型分析无法检测到<5Mb的染色体结构改变,染色体微阵列(CMA)虽然提供了~10Kb的亚显微分辨率,但无法检测平衡性的结构重排;NGS的检测优势在于单碱基水平的核酸序列变异,以及小片段的插入缺失,但NGS对结构变异的识别能力较弱,尤其是在基因组中大量存在的重复片段区域。
由此可见,为了保障基因编辑技术在人类临床应用中的安全性,避免脱靶事件的不良影响,需要使用更全面、敏感的基因组完整性分析策略,对基因编辑工具和基因编辑药物的安全性进行评估。
法规政策
为鼓励和促进体内基因治疗产品的发展,国家药品监督管理局药品审评中心于2022年5月26日发布了《体内基因治疗产品药学研究与评价技术指导原则(试行)》。有7处直接提到CRISPR-Cas,其中提到“对于基于 CRISPR-Cas的基因治疗产品,建议采用多种方法对编辑系统的风险进行全面的分析和评估。例如,编辑系统自身特定的局限性、序列靶向的特异性、脱靶位点的分析、编辑酶的精准度(fidelity)和编辑效率、多靶点编辑的基因组重排、基因组突变等。
随着新型基因编辑工具的不断涌现,客观上也要求鉴定靶向和脱靶位点突变的分析工具不断发展,以满足编辑效率监测的需求,推动基因编辑技术在临床疗法开发领域的落地。
如何检测脱靶?
在中国台湾林口长庚医院牵头的这项研究中,研究人员尝试了新的基因组结构变异检测技术OGM(全基因组光学图谱检测),用于评估13个CRISPR-Cas9编辑的人类多能干细胞系的基因组完整性,研究者在非预期的非同源脱靶位点鉴定了2个大范围结构变异(SV),以及一个靶位点上的结构变异 (>50 Kb的片段缺失),这些脱靶位点和脱靶事件并未能通过 Cas-OFFinder2算法和CRISTA、Elevation等工具获得预测,是以前未被认识的CRISPR-Cas9介导的基因组编辑后的风险事件。
诱导多能干细胞(iPSC)技术近年来被用于研究发病机制、药物筛选、组织工程学以及细胞替代疗法。iPSC用于细胞治疗又分为自体/患者特异性干细胞治疗和同种异体治疗,后者需要建立高HLA配型的细胞库,或者灭活主要组织相容性复合体(MHC)基因和过表达细胞表面蛋白CD47以产生低免疫原性的通用型iPSC,这个过程通过基因编辑技术介入完成。因此作者使用iPSC为模型,探究CRISPR-Cas9基因编辑操作可能引入的染色体/基因组变异。
研究结果
OGM检测出CRISPR-Cas9基因编辑敲除B2M基因后诱发意外的染色体大结构变异
为了评估CRISPR-Cas9介导的基因编辑后的基因组完整性,研究者首先产生了B2M敲除的iPSC。将亲本细胞iPSC NC01的15号染色体上的B2M基因通过瞬时表达Cas9核酸酶和靶向B2M基因1号外显子的sgRNA进行编辑(图1a),再随机选择并分离出三个单细胞克隆(B2M-/-−1、−2和−3)。在B2M基因的外显子1中检测到移码突变,并通过Sanger测序进行验证(图1b)。这三个B2M-/-克隆在细胞表面均不表达HLA I类分子(HLA-ABC),证明了B2M基因的成功敲除(图1c)。
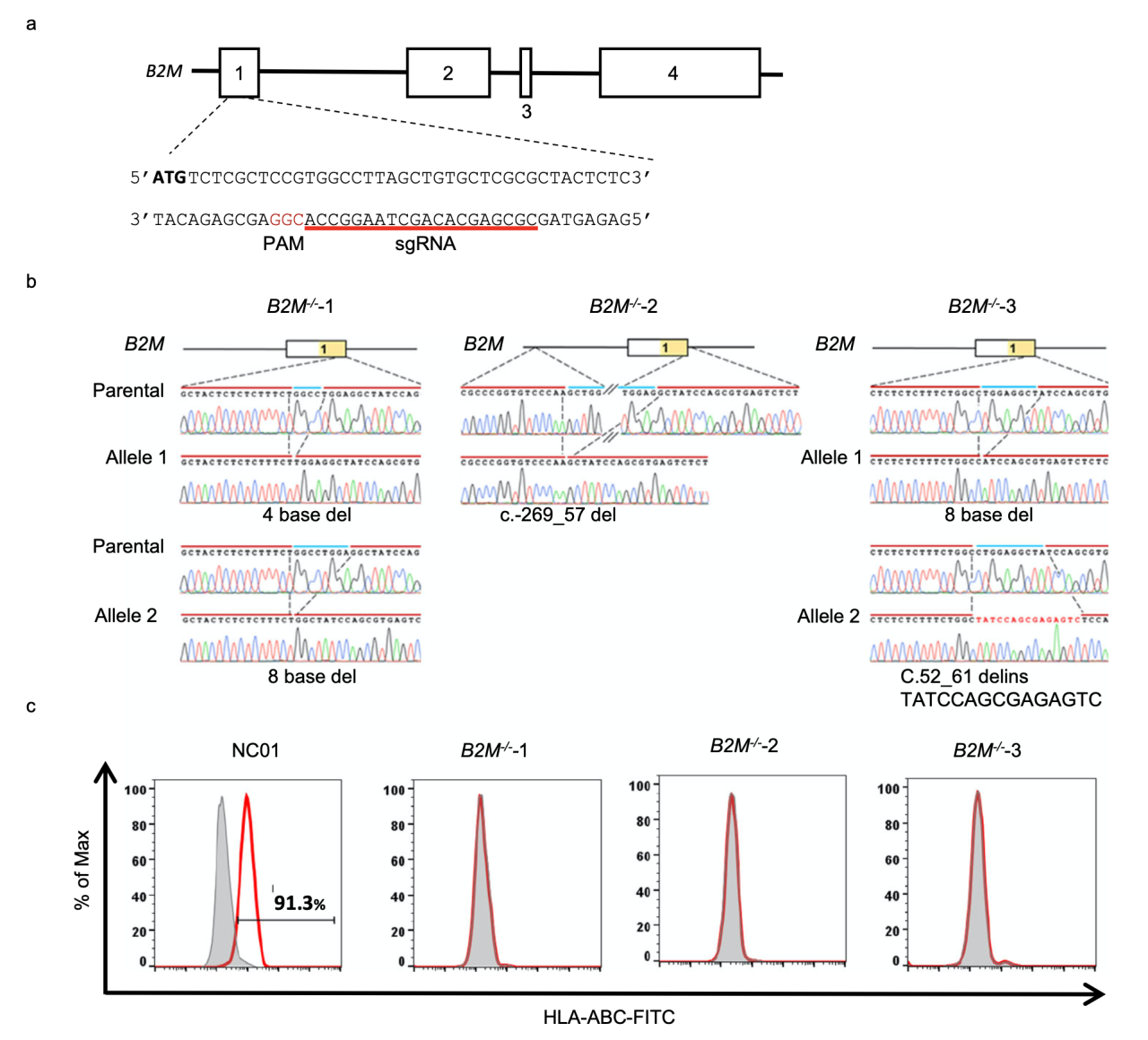
图1 B2M基因编辑工作流程和分析结果。
研究者采用OGM对NC01(亲本细胞)和三个B2M敲除的细胞系进行检测,OGM显示B2M-/-−2位于chr3:41.5Mb基因座上存在136Kb杂合缺失,以及chr15:44.7Mb基因座上的68Kb杂合缺失。在NC01、B2M-/-−1和B2M-/-−3中,未发现大的结构变异(图2)。这些结果有力地证实了CRISPR-Cas9介导的基因敲除诱导了大的染色体结构变异,并具有一定的随机性。
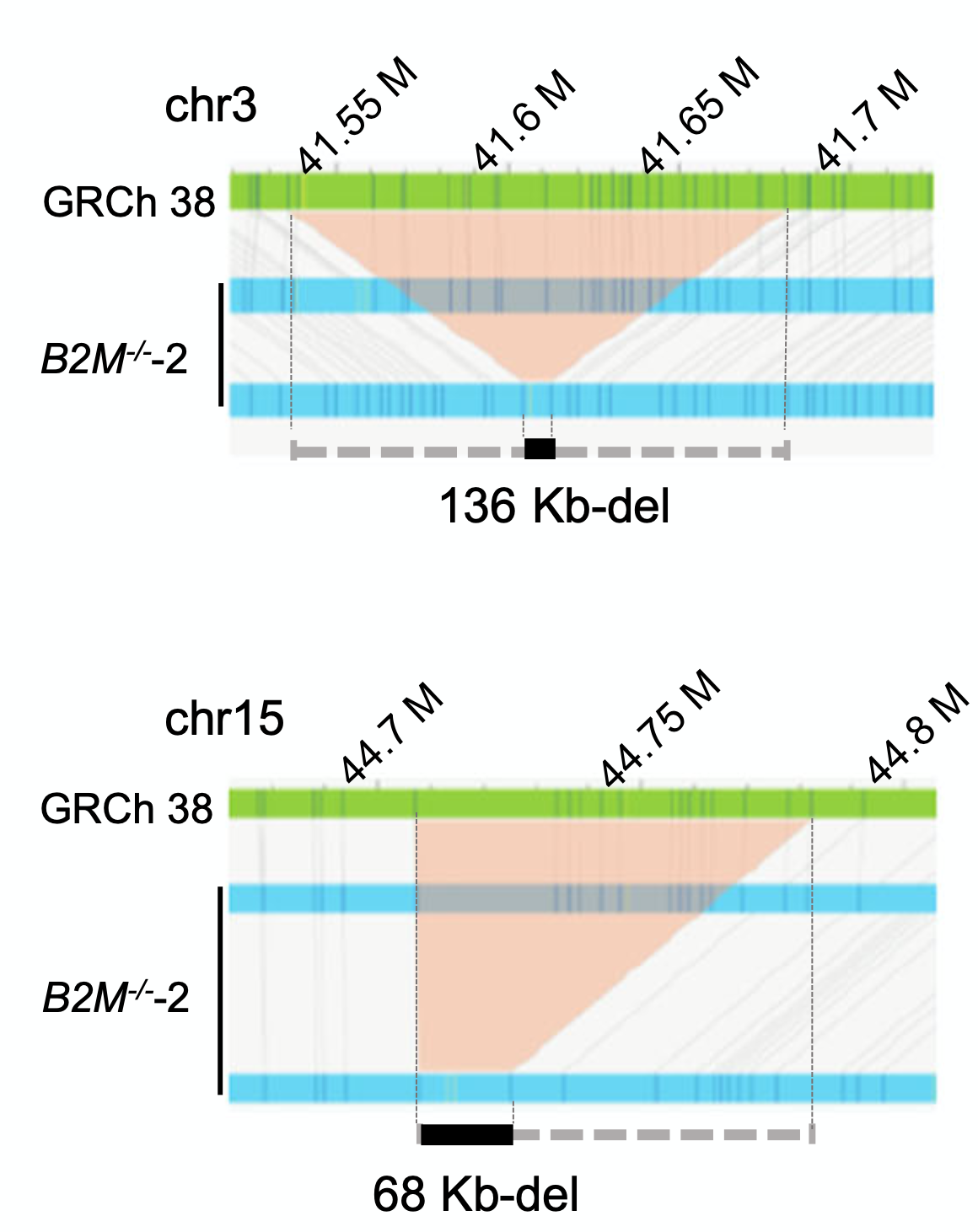
图2 OGM检测结果显示B2M-/-−2与参考基因组比对后识别的杂合缺失事件。浅红色块提示了缺失区域。
CRISPR-Cas9编辑的APP c.2033G>c点突变基因敲入也诱导了非典型非同源脱靶的大结构变异
除了CRISPR-Cas9介导的基因敲除,研究者也对基因敲入进行了检测。对人源iPSC-71进行APP c.2033G>c的点突变编辑,分离到一个纯合基因突变(APPC/C)和一个杂合突变(APPC/G)单细胞克隆。OGM在3号染色体上发现了91.2kb的杂合缺失(图3)。
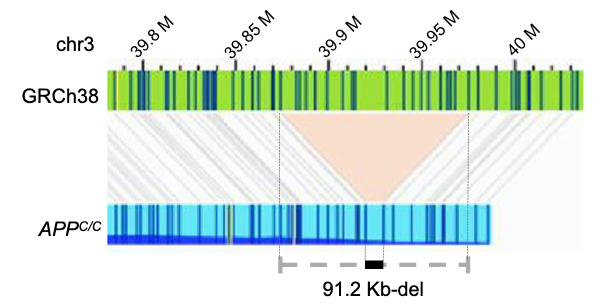
图3 OGM检测结果提示APPC/C的3号染色体上存在91.2 kb的杂合缺失(黑色条段)。
在所有基因编辑的克隆中,用CRISPR-Cas9对同一iPSC系进行基因编辑并不总是会在非典型非同源脱靶位点诱发大的结构变异。研究者并非主张停止使用这种强大的基因编辑工具。相反,为了保障研究和临床应用的基因编辑细胞的安全性,在克隆扩增和长期离体培养之前,研究者主张使用全基因组范围覆盖的检测技术例如OGM对CRISPR-Cas9基因编辑工艺进行评估,以评估确认编辑后细胞克隆的基因组完整性。
随着业界对基因编辑工具的边界不断探索,对基因编辑药物安全性意识的提高,以及法规政策的不断完善细化,OGM技术以其结构变异检测的卓越表现,将有望成为常规的质控工具,为基因编辑保驾护航。
原文参考
https://www.nature.com/articles/s41467-023-40901-x
参考文献
1 Hsu, P. D. et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol. 31, 827–832 (2013).
2 Fu, Y. et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat. Biotechnol. 31, 822–826 (2013).
3 Cradick, T. J., Fine, E. J., Antico, C. J. & Bao, G. CRISPR/Cas9 systems targeting beta-globin and CCR5 genes have substantial off-target activity. Nucleic Acids Res. 41, 9584–9592 (2013).
4 Cullop, G. et al. CRISPR-Cas9 genome editing induces megabase-scale chromosomal truncations. Nat. Commun. 10, 1136 (2019).
5 Aryal, N. K., Wasylishen, A. R. & Lozano, G. CRISPR/Cas9 can mediate high-efficiency off-target mutations in mice in vivo. Cell Death Dis. 9, 1099 (2018).
6 Hoijer, I. et al. CRISPR-Cas9 induces large structural variants at on-target and off-target sites in vivo that segregate across generations. Nat. Commun.13,627 (2022).
OGM技术简介
以核型分析和FISH为代表的细胞遗传学分析技术,是生殖健康、遗传病、罕见病等多个疾病领域的诊断基石,也是细胞系稳定性分析的有力工具。如今新一代高分辨率细胞遗传学分析技术——全基因组光学图谱(Optical genome mapping,OGM)技术在检测分辨率、灵敏度、自动化程度和对复杂遗传学结构变异的解析度方面已然有了重大提升。
Bionano公司开发的OGM技术是一种基于全基因组分子标记图谱进行结构变异分析的技术;以120,000条纳米通道,承载大量Mb级超长DNA分子,最大限度保留DNA完整双链结构形态以进行标记分子的光学扫描;除了染色体非整倍体和拷贝数变异检测,OGM技术更大应用价值点在于可以同时准确发现包括片段缺失、重复、平衡及非平衡易位、杂合性缺失、染色体碎裂及重排等极端复杂的结构变异。这一检测原理很好地填补了目前核型分析和二代测序技术在染色体和基因组结构变异领域的检测空白。

微信号∣Bionano全基因组光学图谱
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发