【Nature子刊】双重效应!哥伦比亚大学顾伟教授团队发现,p53的这种点突变,可同时抑制铁死亡和促肿瘤转移
| 导读 | 众所周知,TP53(p53)是人类癌症中最常见的突变基因,p53错义突变存在于超过40%的人类肿瘤中。大多数p53突变位于DNA结合域内,包括热点突变R175H,R248W和R273H。针对突变型p53蛋白的干预一直是药物开发领域的热点,然而我们对于不同的突变型p53蛋白的生物学调控及其特异性靶向干预一直不清楚。 |
3月27日,美国哥伦比亚大学顾伟教授团队(苏振毅博士为第一作者)在 Nature Cancer 期刊在线发表了题为:Specific regulation of BACH1 by the hotspot mutant p53R175H reveals a distinct gain-of-function mechanism 的研究论文。研究发现,p53热点突变蛋白p53R175H可特异性与转录因子BACH1结合,发挥双重作用:一方面,解除BACH1对SLC7A11下调作用,从而抑制铁死亡,促进肿瘤生长;另一方面,通过上调促转移靶点的表达,促进BACH1依赖的肿瘤转移。

https://www.nature.com/articles/s43018-023-00532-z
研究背景
铁死亡(ferroptosis)是近几年发现的一种新的细胞死亡方式(2012年被命名),是在小分子物质诱导下发生的氧化性细胞死亡,具有铁离子依赖性。铁死亡与帕金森综合征、胰腺癌等多种疾病相关,并发现可以通过激活或抑制铁死亡来干预疾病的发展,因此铁死亡成为近年来的研究热点。
p53基因是最早发现的抑癌基因,也是研究的最多最深入的抑癌基因,p53基因主要通过诱导细胞周期停滞、诱导细胞凋亡等方式抑制癌症,最近的研究表明,p53基因除了诱导细胞凋亡,还可以诱导细胞铁死亡。
尽管p53突变体的功能增益(GOF)已得到充分认可,但目前尚不清楚不同的p53突变体是否具有相同的辅助因子来诱导GOF。为了阐明p53错义突变体在体内执行其功能获得(GOF)的确切机制,研究人员使用蛋白质组学筛选来鉴定。
研究结果
在蛋白质组学筛选中,研究人员将BACH1确定为一种细胞因子,根据其突变状态识别p53 DNA结合结构域。BACH1与p53R175H强烈相互作用,但不能在体内有效结合野生型p53或其他热点突变体进行功能调节。
值得注意的是,p53R175H通过消除BACH1介导的SLC7A11下调来增强肿瘤生长,从而抑制铁死亡;相反,p53R175H通过上调促转移靶点的表达来促进BACH1依赖性肿瘤转移。从机制上讲,p53R175H介导的BACH1功能的双向调节取决于其募集组蛋白去甲基化酶LSD2靶向启动子和差异调节转录的能力。这些数据表明,BACH1是p53R175H执行其特定GOF的独特伙伴,并表明不同的p53突变体通过不同的机制诱导其GOF。
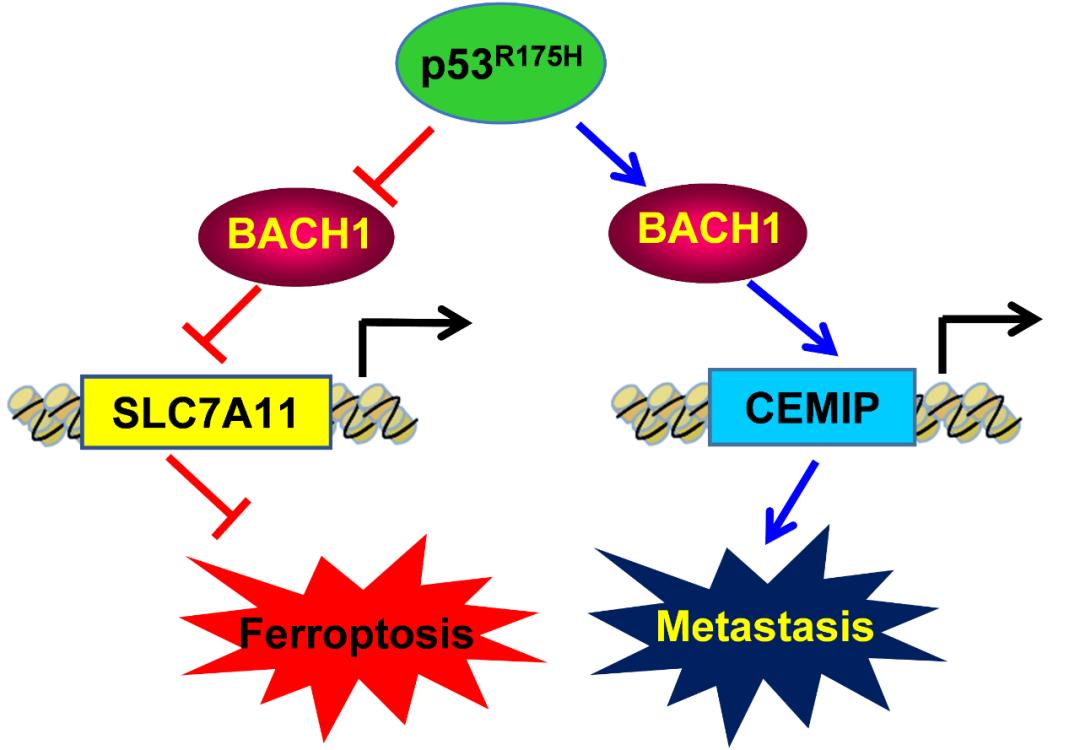
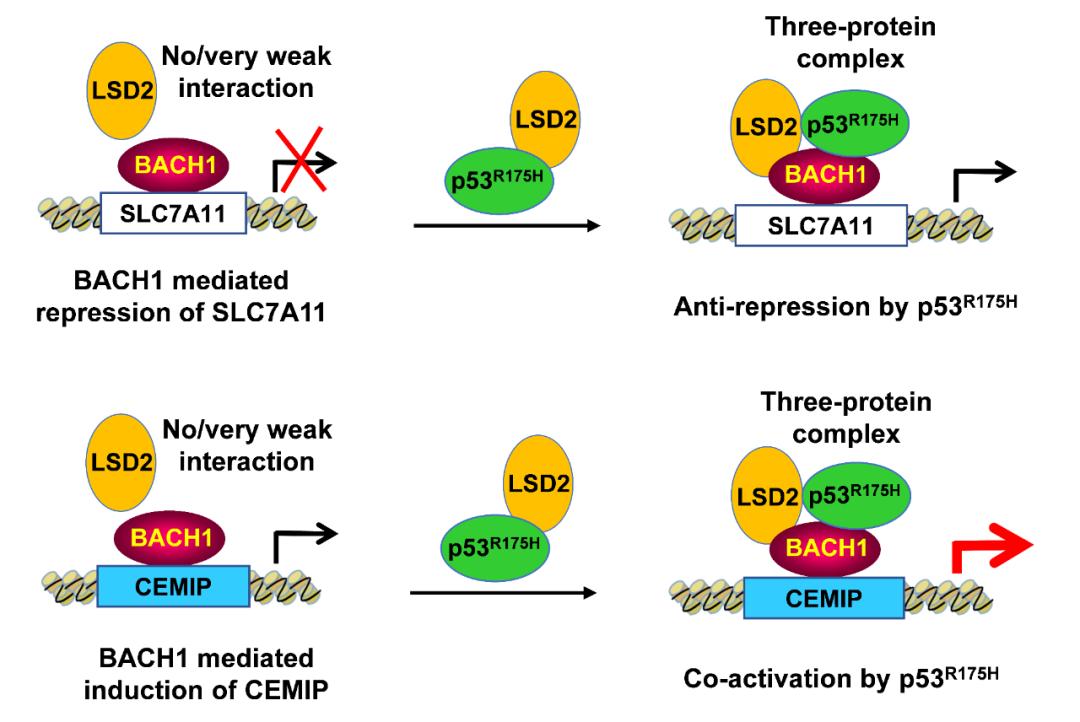
p53R175H通过BACH1发挥抑制铁死亡、促进肿瘤转移的功能和机制
研究意义
综上所述,该研究揭示了BACH1、LSD2是介导p53热点突变蛋白p53R175H促转移作用的关键蛋白,失活BACH1或LSD2可以有效阻断p53R175H介导的肿瘤转移。该研究首次提出并证明了不同突变型p53发挥的gain-of-function机制是可以不同的,这为针对携有不同类型p53突变的癌症患者的个体化治疗提供了可能。未来可以以BACH1或LSD2为药物靶标,设计和开发出针对p53R175H突变患者特异性的抗转移药物。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s43018-023-00532-z
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发